1. Вступление
Термин «дисфагия» означает либо трудность, которую человек может испытывать во время первичных фаз глотания (обычно описываемую как «орофарингеальная дисфагия»), либо ощущение того, что пища или жидкость каким-то образом блокируются во время прохождения от рта до желудка (обычно описываемое как «пищеводная дисфагия»). Таким образом, дисфагия – это ощущение препятствия для нормального прохождения проглоченного материала. Застревание пищи [1] – это особый симптом, который может периодически возникать у этих пациентов.
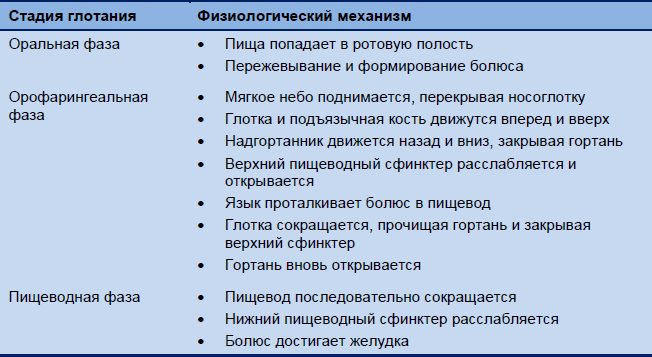
Орофарингеальное глотание – это процесс, управляемый глотательным центром в продолговатом мозге, а в среднем и дистальном отделах пищевода практически автономным перистальтическим рефлексом, координируемым энтерической нервной системой. Таблица 1 показывает физиологические механизмы, вовлеченные в различные фазы этого процесса.
Таблица 1 Физиологические механизмы, вовлеченные в стадии глотания, по фазе
Ключевой вопрос – является ли дисфагия орофарингеальной или пищеводной. Это различие может быть уверено установлено на основании тщательно собранного анамнеза, который предоставляет точную оценку типа дисфагии (орофарингеальная или пищеводная) примерно в 80–85% случаев [2]. Более точная локализация недостоверна. Основными моментами для рассмотрения в медицинском анамнезе (специфика рассмотрена ниже) являются:
- Место возникновения
- Типы пищи и/или жидкости
- Прогрессирующая или периодическая
- Длительность симптомов
Хотя эти состояния часто встречаются совместно, также важно исключить одинофагию (болезненное глотание). Наконец, дифференциальный диагноз, основанный на симптомах, должен исключать globus pharyngeus (ощущение «комка в горле»), внутригрудное давление, диспноэ и фагофобию (страх глотания).
1.1 Причины дисфагии
Когда врач старается установить этиологию дисфагии, полезно прибегнуть к такой же классификации, которая применяется для оценки симптомов — то есть, определить различие между причинами, в основном касающимися глотки и проксимального отдела пищевода (орофарингеальной или «высокой» дисфагией) с одной стороны, и причинами чаще всего относящимися к телу пищевода и пищеводно-желудочному соединению (пищеводная или «нижняя» дисфагия) с другой. Тем не менее, верно то, что многие нарушения могут наслаиваться друг на друга и вызывать как орофарингеальную, так и пищеводную дисфагию. Тщательный сбор анамнеза, включая применение лекарств, очень важен, так как лекарственные препараты могут быть вовлечены в патогенез дисфагии.
Орофарингеальная дисфагия
У молодых пациентов, орофарингеальная дисфагия чаще всего возникает за счет болезней мышц, соединительной ткани или колец. У пожилых пациентов она обычно обусловлена расстройствами центральной нервной системы, включая инсульт, болезнь Паркинсона и деменцию. Нормальное старение может вызывать легкие (редко симптоматические [3]) нарушения подвижности пищевода. Дисфагия у пожилых пациентов не должна автоматически приписываться процессу нормального старения.
В целом, полезно попытаться найти различия между механическими проблемами и нарушениями нейромышечной подвижности, как показано ниже.
Механические и обструктивные причины:
- Инфекции (например, заглоточные абсцессы)
- Увеличение щитовидной железы
- Лимфоаденопатия
- Дивертикул Ценкера
- Сниженная мышечная реакция (миозит, фиброз, перстневидно-глоточная спайка)
- Эозинофильный эзофагит
- Злокачественные новообразования головы и шеи и последствия (например, плотные фибротические стриктуры) хирургического и/или радиотерапевтического вмешательства на этих опухолях
- Цервикальные остеофиты
- Орофарингеальные злокачественные образования и неоплазмы (редко)
Нейромышечные нарушения:
- Заболевания центральной нервной системы, такие как инсульт, болезнь Паркинсона, церебральный или бульбарный паралич (например, рассеянный склероз, болезнь двигательного нерва), амиотрофический латеральный склероз
- Нарушения сократительной способности, такие как тяжелая псевдопаралитическая миастения (myasthenia gravis), окулофарингеальная мышечная дистрофия и другие.
В течение 3 дней после инсульта у 42–67% пациентов развивается орофарингеальная дисфагия — что делает инсульт ее основной причиной. Среди этих пациентов, у 50% возникает аспирация и у одной трети развивается требующая лечения пневмония [4]. Тяжесть дисфагии имеет склонность к связи с тяжестью инсульта. Скрининг на дисфагию среди пациентов, перенесших инсульт, очень важен для профилактики отрицательного исхода за счет аспирации и неадекватной гидратации/питания [5].
До 50% пациентов с болезнью Паркинсона демонстрируют симптомы сходные с орофарингеальной дисфагией, и у почти 95% на видео эзофагографии выявляется патология [6,7]. Клинически значимая дисфагия может появляться на ранних стадиях болезни Паркинсона, но обычно развивается в более поздние периоды.
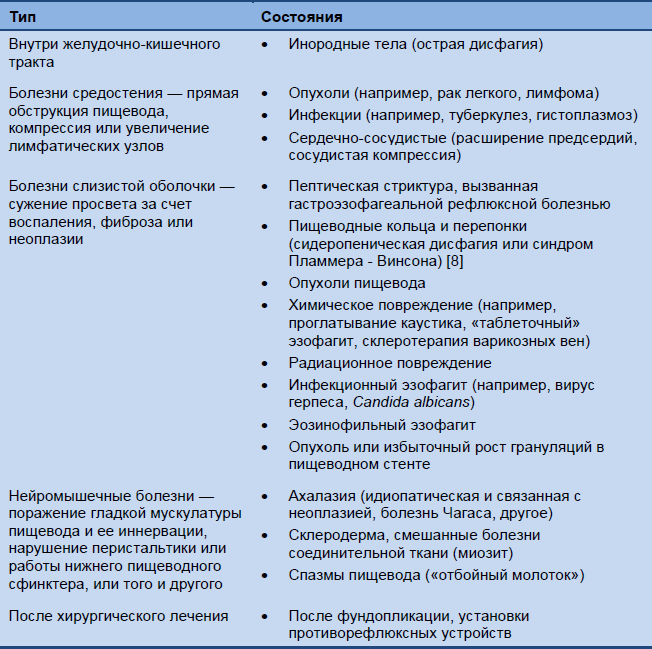
Пищеводная дисфагия
Таблица 2 Наиболее частые причины пищеводной дисфагии
1.2 Каскады ВГО — глобальные практические рекомендации
Каскады — подход в зависимости от ресурсов
Золотой стандартный подход осуществим только при доступности полного спектра диагностических тестов и вариантов медикаментозного лечения. Такие ресурсы для диагностики и лечения дисфагии могут быть доступны в достаточной степени не в каждой стране. Практические рекомендации Всемирной Гастроэнтерологической Организации (ВГО) предоставляют подход в зависимости от ресурсов в форме диагностических и лечебных каскадов.
Каскад ВГО – это иерархический набор диагностических, терапевтических вариантов и вариантов ведения риска и заболевания, разделенных по наличию доступных ресурсов.
Другие публично доступные практические рекомендации
1.3 Бремя заболевания и эпидемиология
Дисфагия – это частая проблема. За время жизни у одного из 17 человек развивается какая-либо форма дисфагии. Исследование 2011 года в Великобритании показывает распространенность дисфагии в 11% в общей популяции [9]. Состояние развивается у 40–70% пациентов с инсультом, у 60–80% пациентов с нейродегенеративными заболеваниями, почти у 13% взрослых в возрасте 65 и старше и у > 51% пожилых пациентов в домах престарелых [10,11]. Также ей страдают 60–75% пациентов, получающих радиотерапию по поводу рака головы и шеи.
Бремя заболевания дисфагией четко описано в резолюции конгресса в США в 2008 [12], где отмечается, что:
- Дисфагией страдает практически 15 миллионов американцев; все американцы старше 60 лет испытывают дисфагию в тот или иной момент.
- Центры по Контролю и Профилактике Заболеваний считают, что диагноз дисфагии устанавливается ежегодно 1 миллиону человек в США.
- Агентство по Исследованию и Качеству Здравоохранения показывает, что 60,000 американцев умирают ежегодно от осложнений, связанных с дисфагией.
- Осложнения, вызванные дисфагией, повышают стоимость медицинского обслуживания за счет повторных госпитализаций, госпитализаций в реанимацию, длительного пребывания в стационаре, необходимости длительного реабилитационного курса, необходимости дорогостоящей поддержки дыхания и питания.
- Включая средства, потраченные в госпиталях, общая стоимость дисфагии для системы здравоохранения ежегодно сильно превышает $1 миллиард.
- Дисфагия является состоянием, жалобы на которое не всегда сообщаются, и которое недостаточно понятно широкой публике.
Эпидемиологические данные в мировом масштабе сложно обобщить, так как частота большинства заболеваний, вызывающих дисфагию, склонна различаться между регионами и континентами. Следовательно, на глобальном уровне, возможно говорить только о приблизительных данных. Уровни частоты также варьируют в зависимости от возраста пациента, и необходимо помнить, что диапазон нарушений, связанных с детской дисфагией, отличается от такового в старших возрастных группах. У более молодых пациентов дисфагия часто отмечается при травмах головы и шеи, а также при раке области шеи и ротовой полости. Дисфагия в целом встречается во всех возрастных группах, но с возрастом ее частота возрастает.
Частота опухолей различается в разных странах. В США и Европе, например, наиболее частым видом рака пищевода является аденокарцинома, в то время как в Индии и Китае – это плоскоклеточная карцинома. Подобным образом, коррозивные стриктуры пищевода (после проглатывания коррозивных веществ с суицидальными намерениями) и туберкулез могут являться важными аспектами в незападных странах.
Региональные особенности
- Северная Америка/США:
- Частота стриктур, вызванных рефлюксом, в США снижается после широкого распространения ингибиторов протонной помпы [13].
- Эозинофильный эзофагит с возрастающей частотой признается главной причиной дисфагии у детей и взрослых [13].
- Частота развития рака пищевода увеличивается, хотя абсолютное количество пациентов с этим диагнозом в США остается малым.
- С увеличение популяции пожилых пациентов в США, компрессия цервикальными остеофитами, инсульт и другие неврологические расстройства становятся более важными причинами дисфагии, чем в прошлом.
- Широкое использование абляционных методов лечения при пищеводе Барретта (радиочастотной абляции, фотодинамической терапии и эндоскопической резекции слизистой оболочки) вероятно, ведет к появлению новой группы пациентов со стриктурами, вызванными эндотерапией.
- Европа/Западные страны:
- В то время как гастроэзофагеальная рефлюксная болезнь (ГЭРБ) и пептические стриктуры снижаются по частоте, как причины пищеводной дисфагии, частота аденокарциномы и эозинофильного эзофагита возрастает [14–16].
- Азия [17,18]:
- Частые причины пищеводной дисфагии – это пищеводная плоскоклеточная карцинома, ахалазия и связанные с хирургическим лечением стриктуры. Частота ГЭРБ, по всей видимости, возрастает, но по сравнению с западными странами, в Азии она все еще распространена меньше. В Азии довольно часто встречается постинсультная дисфагия, и улучшение здравоохранения постепенно приводят к ее раннему узнаванию и лечению.
- Латинская Америка:
- В некоторых частях Латинской Америки очень распространена болезнь Чагаса. Могут развиваться чагастическая ахалазия и мегаэзофагус, что приводит к мальнутриции. Некоторые признаки ахалазии Чагаса отличаются от идиопатической ахалазии. Давление в нижнем пищеводном сфинктере имеет склонность к нижним показателям, очевидно за счет повреждения как возбуждающих, так и ингибирующих контрольных механизмов. Тем не менее, терапевтическое и хирургическое лечение одинаковы [19].
- Африка:
- В Африке лечение постинсультной дисфагии может быть неоптимальным за счет недостаточных доступных ресурсов или их неверного распределения. Отсутствие квалифицированных и знающих медицинских профессионалов также может сказаться на менее чем оптимальном ведении пациентов. Также отсутствуют специализированные палаты для инсульта и инструментарий – в частности, аппаратура, необходимая для проведения «золотого стандарта» - модифицированного бариевого глотка [20].
2. Клинический диагноз
Необходим аккуратно собранный анамнез, освещающий все ключевые диагностические элементы, часто позволяющий с уверенностью поставить диагноз. Важно тщательно установить локацию предполагаемой проблемы с глотанием: орофарингеальная или пищеводная дисфагия.
2.1 Орофарингеальная дисфагия
Клинический анамнез
Орофарингеальная дисфагия также может называться «высокой», что относит ее к ротовой или глоточной локации. У пациентов возникает трудность в инициации глотания, и они обычно называют представляющей проблему цервикальную область.
У неврологических пациентов орофарингеальная дисфагия представляет собой высоко преобладающее коморбидное состояние, связанное с отрицательными эффектами на состояние больного, такими как дегидратация, мальнутриция, пневмония и смерть. Нарушение глотания может вызывать усиление тревожности и страха, которые могут привести пациента к избеганию орального приема пищи и жидкости – результатом чего становятся мальнутриция, депрессия и изоляция. Частые сопутствующие симптомы:
- Трудность в инициации глотания, повторное глотание
- Регургитация в нос
- Кашель
- Речь в нос
- Слюнотечение
- Сниженный кашлевой рефлекс
- Удушье (n.b.: попадание и аспирация в гортань могут происходить без сопутствующего удушья или кашля)
- Дизартрия и диплопия (могут сопровождать неврологические состояния, вызывающие орофарингеальную дисфагию)
- Галитоз у пациентов с большим, наполненным содержимым дивертикулом Ценкера, или у пациентов с выраженной ахалазией или длительной обструкцией с накоплением в просвете пищевода разлагающегося содержимого
- Рецидивирующая пневмония
Точный диагноз возможен, когда имеется определенное неврологическое состояние, сопровождающееся орофарингеальной дисфагией, такое как:
- Гемипарез, следующий за ранее произошедшей цереброваскулярной катастрофой
- Птоз век и утомляемость, позволяющие предположить псевдопаралитическую миастению
- Скованность, дрожь и вегетативная дистония, позволяющие предположить болезнь Паркинсона
- Другие неврологические заболевания, включая цервикальную дистонию и компрессию краниальных нервов, такие как гиперостоз или деформация Арнольда – Киари (грыжи ромбовидного мозга)
- Специфический недостаток краниальных нервов, вовлеченных в акт глотания, также может помочь в определении происхождения орофарингеальных нарушений и установлении диагноза
Тестирование
Тесты для оценки дисфагии могут быть выбраны в зависимости от характеристик пациента, тяжести проблемы и доступной экспертизы. Больные с инсультом должны быть обследованы на наличие дисфагии в течение первых 24 часов после начала заболевания и до орального приема пищи. Это действие приводит к трехкратному уменьшению риска развития осложнений, связанных с дисфагией. Пациенты с персистирующей потерей веса и рецидивирующей инфекций органов грудной клетки должны быть обследованы в срочном порядке [21].
Протокол оценки глотания у постели больного был разработан Американской Ассоциацией Речи-Языка-Слуха (ASHA); шаблон доступен на http://www.speakingofspeech.info/medical/BedsideSwallowingEval.pdf. Этот недорогой способ дает возможность детального и структурного подхода к механизмам орофарингеальной дисфагии и ее ведению. Он может использоваться в регионах с ограниченными ресурсами.
Главными тестами для оценки орофарингеальной дисфагии являются:
- Видео флюороскопия, также известная как «модифицированный бариевый глоток»
- Это – золотой стандарт для оценки орофарингеальной дисфагии [22–24].
- Глотание записывается на видео во время флюороскопии, обеспечивая деталями контроль за глотательными движениями пациента.
- Также может помочь в прогнозировании риска аспирационной пневмонии [25].
- Видео-флюороскопические записи можно просматривать на медленной скорости или покадрово, а также они могут быть переданы через интернет для интерпретации в отдаленных местах [26].
- Эндоскопия верхних отделов
- Назоэндоскопия – это золотой стандарт для оценки структурных причин дисфагии [22–24] — например, повреждений ротоглотки — и выявления скопившихся секреторных выделений или остатков пищи.
- Эндоскопия не является чувствительным методом для выявления патологической глотательной функции.
- Она не эффективна в выявлении аспирации в 20–40% случаев, когда проводится с видео флюороскопией из-за отсутствия кашлевого рефлекса
- Фиброоптическая эндоскопическая оценка глотания (FEES)
- FEES – это модифицированный метод включающий визуальный осмотр гортанных и глоточных структур через трансназальный гибкий фиброоптический эндоскоп во время приема пациентом пищи и жидкости.
- Фарингоэзофагеальная манометрия с высоким разрешением
- Это – количественная оценка давления и времени сокращения глотки и релаксации верхних отделов пищевода.
- Может быть использована вместе с видео флюороскопией для лучшего понимания вовлеченных движений и давления.
- Может иметь определенную ценность для больных с орофарингеальной дисфагией, несмотря на негативные результаты традиционного исследования с барием.
- Может быть полезна при рассмотрении вопроса о хирургической миотомии.
- Автоматическая импеданс-манометрия (AIM) [27]
- Это – комбинация импеданс-манометрии и манометрии с высоким разрешением.
- Переменные давления – потока выводятся из автоматического анализа комбинированных манометрических/импедансных измерений, предоставляя ценную диагностическую информацию.
- При их комбинации для определения индекса риска глотания (SRI), эти измерения являются надежным прогностическим методом аспирации.
- Тест с глотком воды
- Это дешевый и потенциально полезный базовый скрининговый тест в совокупности с данными, полученными из анамнеза и физикального осмотра.
- При проведении теста пациент максимально быстро выпивает 150 мл воды, в то время как исследователь фиксирует количество глотков. Из этих данных высчитывается скорость глотания и средний объем глотка. Сообщается, что тест обладает прогностической чувствительностью > 95% для определение наличия дисфагии, и может быть дополнен «пищевым тестом» с использованием маленького кусочка пудинга или хлеба, расположенного на корне языка [28].
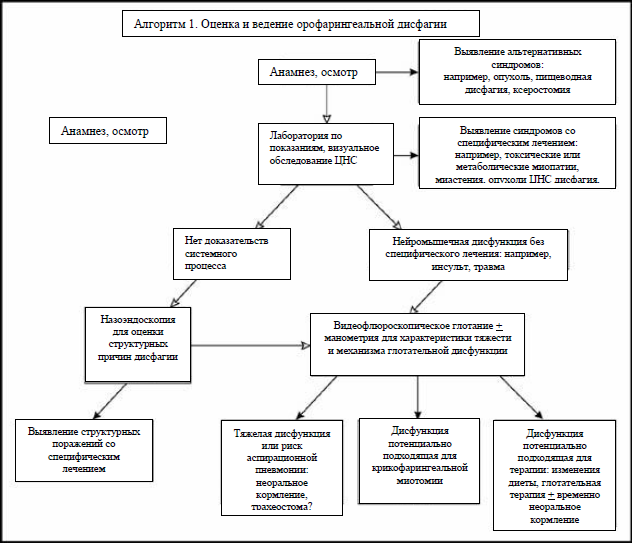
Алгоритм, изображенный на Рис. 1 представляет показания для более сложных тестов и процедур, необходимых для проведения диагностики и назначения специфического лечения.
Рис. 1 Оценка и ведение орофарингеальной дисфагии
2.2 Пищеводная дисфагия
Дифференциальный диагноз
Наиболее частые состояния, связанные с пищеводной дисфагией, это:
- Пептическая стриктура — встречается у до 10% пациентов с ГЭРБ [29,30], но при применении ингибиторов протонной помпы частота снижается
- Пищеводная неоплазия — включая неоплазию кардии и псевдоахалазию
- Пищеводные спайки и кольца
- Ахалазия, включая другие первичные и вторичные нарушения подвижности пищевода
- Склеродерма
- Спастические нарушения подвижности
- Функциональная дисфагия
- Радиационные поражения
Редкие причины:
- Лимфоцитарный эзофагит
- Кардиоваскулярная патология
- Вовлечение пищевода при болезни Крона
- Повреждения едкими веществами
Клинический анамнез
Пищеводная дисфагия также может называться «нижней» дисфагией, что имеет отношение к вероятной локализации процесса в нижних отделах пищевода – хотя необходимо отметить, что некоторые пациенты с различными формами пищеводной дисфагии, такими как ахалазия, могут ощущать симптомы в области шеи, что маскируется под орофарингеальную дисфагию.
- Дисфагия, которая возникает одинаково при приеме твердой и жидкой пищи, часто вовлекает проблемы с подвижностью пищевода. Это подозрение усиливается, когда периодическая дисфагия при твердой и жидкой пище связана с болями в грудной клетке.
- Дисфагия, которая возникает только при приеме твердой пищи, и никогда жидкости, позволяет предположить возможность механической обструкции, со стенозом просвета до диаметра менее < 15 мм. Если дисфагия прогрессирует, в частности должно рассматриваться наличие пептической стриктуры или карциномы. Также необходимо отметить, что пациенты с пептическими стриктурами обычно имеют длительный анамнез изжоги и регургитации, но не отмечают потери веса. Напротив, пациенты с раком пищевода чаще бывают старшего возраста и с выраженной потерей веса.
- В случаях периодической дисфагии при приеме пищи, особенно у молодых людей, нужно подозревать наличие эозинофильного эзофагита.
Физикальный осмотр пациентов с пищеводной дисфагией обычно несет в себе ограниченную ценность, хотя у пациентов с раком пищевода может определяться шейная/надключичная лимфоаденопатия. У некоторых больных со склеродермой и вторичными пептическими стриктурами также может быть выявлен CREST-синдром (кальциноз, феномен Рейно, вовлечение пищевода, склеродактилия и телеангиоэктазия).
Галитоз – это очень неспецифический признак, который может указывать на наличие выраженной ахалазии или длительной обструкции с аккумуляцией медленно разлагающихся остатков пищи в просвете пищевода.
Клиническая история представляет собой краеугольный камень оценки и должна рассматриваться в первую очередь. Главной задачей при пищеводной дисфагии является исключение злокачественного поражения. В этом может помочь анамнез пациента. Злокачественное заболевание вероятно в случае, если имеется:
- Короткая длительность заболевания – менее 4 месяцев
- Прогрессирование заболевания
- Дисфагия выражена больше при приеме твердой пищи, чем жидкости
- Потеря веса
С другой стороны, более вероятна ахалазия, если:
- Дисфагия при приеме как твердой пищи, так и жидкости. Дисфагия при приеме жидкости говорит сильнее в пользу этого диагноза.
- Имеется пассивная ночная регургитация слизи или пищи.
- Проблема существует на протяжение нескольких месяцев или лет.
- Пациент приминает дополнительные меры для ускорения прохождения пищи, например, запивает ее или меняет положение тела.
Эозинофильный эзофагит более вероятен, если имеется:
- Преходящая дисфагия, связанная с периодическим приемом пищи.
Исследования
Основой для первичных исследований является анамнез. Пациентам обычно требуется раннее посещение врача, так как большинству необходимо проведение эндоскопии. Алгоритм, показанный на Рис.2 определяет решение о том, что должно стать первичным исследованием: эндоскопия или бариевый глоток.
- Эндоскопическая оценка:
- Видеоэндоскоп (фиброоптические эндоскопы в настоящее время в основном заменены на электронные или видеоэндоскопы) проводится через рот в желудок с детальной визуализацией верхних отделов желудочно-кишечного тракта.
- Если видео эндоскопия с высоким разрешением доступна, она может быть использована для выявления тонких изменений, таких как типичных беловатые островки при эозинофильном эзофагите.
- Введение эндоскопа в полость желудка очень важно для исключения псевдоахалазии, вызванной опухолью пищеводно-желудочного сочленения.
- Эндоскопия делает возможным получение образцов тканей и выполнения терапевтических манипуляций.
- Эндоскопическое ультразвуковое исследование (ЭУЗИ) полезно в некоторых случаях обструкции выходного отверстия.
- Контрастная эзофаграмма с барием (бариевый глоток):
- Бариевые эзофаграммы, выполненные в положении пациента лежа и стоя могут выявить изменения в просвете пищевода и идентифицировать большинство случаев обструкции, перемычек и колец.
- Исследование ротоглотки и пищевода с барием в момент глотания – это самый информативный первичный тест у пациентов с анамнезом или клиническими признаками, предполагающими поражение проксимальных отделов пищевода. В опытных руках это исследование может быть более чувствительным и безопасным, чем эндоскопия верхних отделов ЖКТ.
- Оно также может оказать помощь в выявлении ахалазии и диффузного спазма пищевода, хотя эти состояния более точно диагностируются посредством манометрии.
- Для идентификации тонких структур целесообразно применение бариевой таблетки. Бариевый глоток также может помочь при обследовании пациентов с дисфагией и негативными эндоскопическими результатами, если была добавлена бариевая таблетка.
- Полноценное рентгенологическое исследование [31] оказывает помощь при подозрении на тонкое механическое препятствие, несмотря на негативные результаты эндоскопии верхних отделов ЖКТ.
- Синхронизированная бариевая эзофаграфия очень эффективна для оценки ахалазии до и после лечения.
- Пищеводная манометрия:
- Этот диагностический метод основан на записи давления в просвете пищевода с использованием твердотельной или перфузионной техники.
- Манометрия показана, когда имеется подозрение на пищеводную причину дисфагии после неубедительных результатов бариевого глотка и эндоскопии. За ней следует адекватная антирефлюксная терапия, когда заживление пищевода подтверждается эндоскопически.
- Три главные причины дисфагии, которые могут быть диагностированы с использованием пищеводной манометрии – это ахалазия, склеродерма и пищеводный спазм.
- Пищеводная манометрия с высоким разрешением (МВР) с пищеводной топографией давления (ПТД):
- Используется для оценки нарушений подвижности пищевода.
- Основана на одновременной записи с катетеров, несущих до 36 сенсорных датчиков, расположенных продольно и радиально для записи показаний со сфинктеров и с тела пищевода, с созданием трехмерного формата для изображения результатов исследования.
- Диагностическая алгоритмическая схема Чикагской Классификации (ЧК) позволяет создать иерархическую категоризацию нарушений подвижности пищевода. ЧК прояснила диагноз ахалазии и дистального пищеводного спазма.
- Сцинтиграфия с радионуклидным транзитом по пищеводу:
- Пациент проглатывает радиоактивно помеченную жидкость (на пример, воду, смешанную с серным коллоидом технеция Tc 99m или радиоактивно помеченную пищу), и затем измеряется радиоактивность пищевода.
- У пациентов с нарушениями подвижности пищевода обычно отмечается замедленное прохождение радиомаркера по пищеводу. Таким образом, можно подозревать нарушения подвижности у пациентов с негативными результатами эндоскопии и патологическим временем транзита.
- Когда используются тесты с барием и импеданс-МВР, пищеводная сцинтиграфия малоинформативна.
Рис. 2 Оценка и ведение пищеводной дисфагии

2.3 Диагностические каскады
Таблицы 3 и 4 представляют альтернативные диагностические варианты для ситуаций в ограниченных ресурсах, средних ресурсах или обширных ресурсах.
Таблица 3 Каскад: диагностические варианты при орофарингеальной дисфагии

КТ, компьютерная томография; ПЭТ, позитронно-эмиссионная томография.
Таблица 4 Каскад: диагностические варианты для пищеводной дисфагии

КТ, компьютерная томография; ПЭТ, позитронно-эмиссионная томография.
3. Варианты лечения
3.1 Орофарингеальная дисфагия
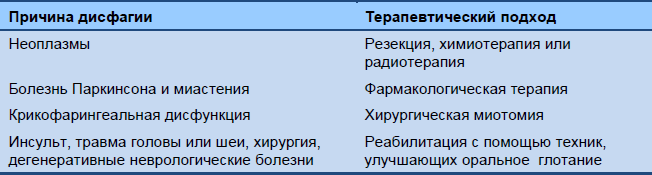
Целями лечения являются улучшение движения пищи и жидкости для предотвращения аспирации. Причина дисфагии – это важный фактор для выбора подхода.
Таблица 5 Орофарингеальная дисфагия: причины и подход к лечению
Ведение осложнений имеет огромное значение. В этом отношении, при рассмотрении выбора терапии ключевым элементом является определение риска аспирации. Для пациентов, проходящих активный курс реабилитации после инсульта, лечение дисфагии должно быть максимально толерантным. Могут применяться простые меры – например, решение дентальных проблем с помощью протезов, модификация свойств потребляемой жидкости [32] и пищи [33], или изменение объема болюса.
- Глотательная реабилитация и повторное обучение:
- Могут быть предложены соответствующие постуральные, питательные и поведенческие изменения.
- Относительно простые маневры во время глотания могут уменьшать орофарингеальную дисфагию.
- Специфическое глотательное обучение специалистом по данным расстройствам.
- Разработаны различные терапевтические глотательные техники для улучшения нарушений глотания. Они включают в себя укрепляющие упражнения и биологическую обратную связь.
- Модификации питания и диеты:
- Эффективен прием более мягкой пищи, возможно, в сочетании с постуральными мерами.
- При возможности, лучшим вариантом является оральное кормление. Важное значение может иметь изменение консистенции пищи до состояния густой жидкости и применение мягких видов пищи [34].
- Необходимо следить за потребностью в жидкости и пище (в свете риска дегидратации).
- Добавление к пище лимонной кислоты улучшает глотательные рефлексы, возможно, за счет повышения вкусовой стимуляции и стимуляции тройничного нерва, обеспечиваемых кислотой [35].
- Также может помочь дополнительная терапия ингибитором ангиотензин-конвертирующего фермента, усиливающего кашлевой рефлекс [36].
- Альтернативные питательные добавки:
- Гибкая мягкая питательная трубка, введенная под рентгенологическим контролем, должна рассматриваться как вариант при высоком риске аспирации, или в случаях, когда оральный прием пищи не обеспечивает адекватный нутрициональный статус.
- Питание через гастростому после инсульта снижает уровень смертности и улучшает состояние питания у пациентов по сравнению с назогастральным кормлением.
- Чрезкожная эндоскопическая гастростомия включает в себя введение гастростомической трубки в желудок под контролем эндоскописта, и если это возможно, является обычно более предпочтительной, чем хирургическая гастростомия.
- Вероятность того, что питательные зонды в последствии будут удалены, ниже у пожилых пациентов с билатеральным инсультом, или у пациентов, имевших аспирацию во время первичного видео флуоресцентного исследования [37].
- Зондовое кормление через тощую кишку должно применяться в острой ситуации, а чрезкожная эндоскопическая гастростомия или еюностомический зонд – в хронических условиях.
- Хирургическое лечение направлено на облегчение спастических причин дисфагии, таких как крикофарингеальная миотомия, успешно до 60% случаев, но его применение остается противоречивым [38]. С другой стороны, открытая хирургия и эндоскопическая миотомия у пациентов с дивертикулом Ценкера является широко распространенными методами лечения.
3.2 Пищеводная дисфагия
Острая дисфагия требует немедленной оценки и вмешательства. У взрослых самой частой ее причиной является застревание пищи. Может иметь место скрытый компонент механической обструкции. После удаления застрявшего болюса отмечается немедленное улучшение. Должны быть приняты меры, исключающие риск перфорации при проталкивании вниз инородного тела.
Список вариантов ведения, которые следует рассматривать, при пищеводной дисфагии отображен в Таблице 6.
Таблица 6 Варианты ведения при пищеводной дисфагии
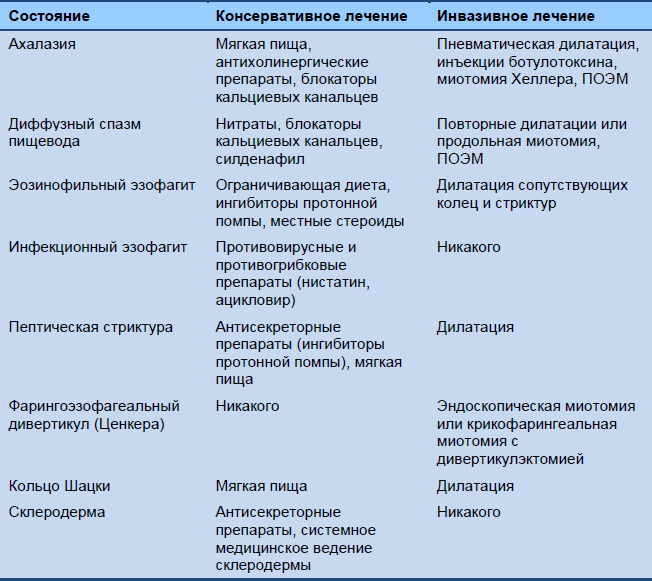
ПОЭМ, пероральная эндоскопическая миотомия.
Пептические стриктуры пищевода
Пептические стриктуры обычно являются результатом гастроэзофагеальной рефлюксной болезни (ГЭРБ), но также могут быть вызваны воздействием лекарственных препаратов. Дифференциальный диагноз должен исключать:
- Каустические стриктуры после воздействия коррозивных химических веществ
- Лекарственные стриктуры
- Послеоперационные стриктуры
- Грибковые стриктуры
- Эозинофильный эзофагит
Когда стриктуры подтверждены эндоскопически, методом выбора является постепенная дилатация [39,40] бужом Savary. Балонная дилатация является альтернативным вариантом, но несет большую степень риска.
- Агрессивная антирефлюксная терапия ингибиторами протонной помпы - такими как омепразол 20 мг 2 раза в день или его эквиваленты – или фундопликация улучшают дисфагию и уменьшают необходимость последующих дилатаций пищевода у пациентов с пептическими пищеводными стриктурами. Некоторым пациентам может потребоваться назначение более высоких доз.
- Пациентам с персистирующей или рецидивирующей дисфагией после первичного проведения дилатации и антирефлюксной терапии, перед повторной дилатацией необходимо эндоскопическое подтверждение заживления слизистой пищевода.
- Когда заживление пищевода достигнуто, необходимость в последующей дилатации определяется эмпирически.
- Пациенты, испытывающие только кратковременное облегчение дисфагии после дилатации, должны быть обучены технике самобужирования.
- При рефрактерных стриктурах терапевтические методы включают инъекцию стероидов в место поражения перед дилатацией и эндоскопическое электрохирургическое иссечение стриктуры.
- Редко, истинные рефрактерные стриктуры требуют пищеводной резекции и реконструкции.
- В исключительных случаях, у пациентов с доброкачественными стриктурами, может быть показано эндолюминальное протезирование [41]. Риск перфорации составляет около 0.5%, и в данных условиях часто отмечается миграция стента.
- Хирургия в целом показана при появлении открытой перфорации, но в настоящее время разработаны эндоскопические методы закрытия раны.
Лечение слизистых колец нижних отделов пищевода (включая кольцо Шацки)
- Дилатационная терапия слизистых колей нижних отделов пищевода включает проведение одиночного большого бужа (45–60 мм) или баллонную дилатацию (18–20 мм), направленных на разрушение (а не просто растягивание) колец.
- После радикальной дилатации, любой рефлюксный эзофагит агрессивно лечится с помощью ингибиторов протонной помпы в высоких дозах.
- Необходимость последующих дилатаций определяется эмпирически. Тем не менее, рецидив дисфагии возможен, и пациенты должны быть предупреждены о вероятности повторной дилатации. В таких случаях необходимо взятие биопсии слизистой пищевода для исключения возможного эозинофильного эзофагита.
- Пищеводная манометрия рекомендована пациентам с персистирующей или быстро рецидивирующей дисфагией, несмотря на адекватную дилатацию и антирефлюксную терапию.
- У пациентов с излечимыми нарушениями подвижности, такими как ахалазия, терапия направлена на решение проблем подвижности.
- Если излечимые проблемы с подвижностью не выявлены, проводится повторная эндоскопия для подтверждения заживления эзофагита и разрушения кольца.
- Пациентам с персистирующими кольцами обычно требуется повторное проведение дилатации.
- Рефрактерные кольца, которые не отвечают на дилатацию стандартными баллонами и бужами, могут быть подвергнуты эндоскопическому электрохирургическому иссечению и хирургической резекции. Эти методы лечения востребованы редко и только у пациентов со слизистыми кольцами в нижних отделах пищевода, и только после исключения других причин дисфагии.
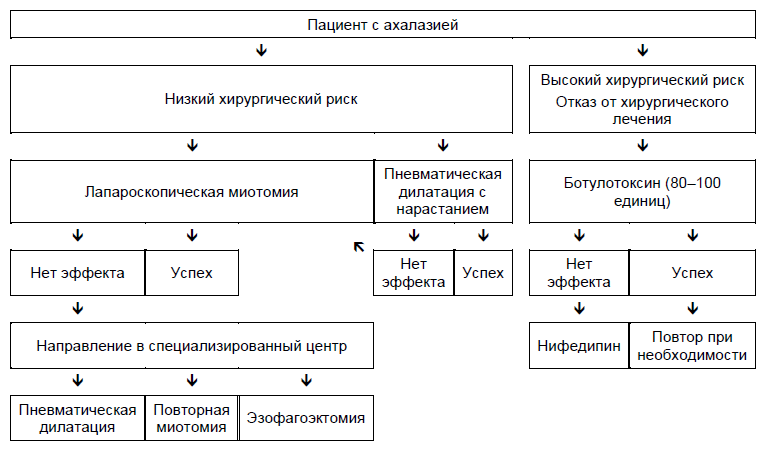
Ахалазия
- Должна исключаться возможность псевдоахалазии (пожилой возраст, быстрая и значительная потеря веса) или болезни Чагаса.
- Ведение ахалазии в основном зависит от хирургического риска.
- Медикаментозная терапия нитратами или блокаторами кальциевых канальцев часто неэффективна и плохо переносима.
- Инъекция ботулотоксина может быть использована как первичная терапия у пациентов с повышенным хирургическим риском, если врач считает, что медикаментозное лечение и пневматическая дилатация будут плохо переносимы. Инъекция ботулотоксина считается безопасной процедурой, которая может вызвать клиническую ремиссию минимум на 6 месяцев приблизительно у двух третьих пациентов с ахалазией. Тем не менее, большинству пациентов потребуется повторная инъекция для поддержания ремиссии. Долговременные результаты этого метода разочаровывают, и некоторые хирургу считают, что оперативное лечение становится труднее для проведения из-за рубцов, вызванных инъекциями.
- Если вышеперечисленные методы лечения оказались неэффективными, врач и пациент должны решить перевешивает ли потенциальная польза пневматической дилатации или миотомии значительные риски, которые могут возникать при проведении данных процедур у пожилых или ослабленных больных.
- У пациентов, вариантом для которых является хирургия, большинство гастроэнтерологом начинают с проведения пневматической дилатации с помощью эндоскопа и решения о лапароскопической миотомии по Хеллеру у пациентов с неэффективными двумя или тремя возрастающими пневматическими дилатациями (30-мм, 35-мм и 40-мм баллонами). Некоторые гастроэнтерологи решают начинать непосредственно с хирургического лечения без предварительной пневматической дилатацией, или ограничить диаметр дилататоров до 30–35 мм.
- Пероральная эндоскопическая миотомия (ПОЭМ) становится широко доступной как альтернатива пневматической дилатации или миотомии Геллера.
- Если эти методы лечения неэффективны, особенно у пациентов с декомпенсированным эзофагитом, может потребоваться эзофагоэктомия.
- Питательный зонд через гастростому – это альтернатива пневматической дилатации или миотомии, но многие неврологически интактные пациенты считают, что жизнь с гастростомой неприемлема.
Рис. 3 Варианты ведения пациентов с ахалазией
Эозинофильный эзофагит
- Эозинофильный эзофагит – это воспаление пищевода, вызванное аллергеном [42].
- Диагноз основывается на гистологическом исследовании биопсии слизистой оболочки из верхней и нижней частей пищевода после первичного лечения ингибиторами протонной помпы в течение 6 – 8 недель. Приблизительно у одной трети пациентов с подозрением на эозинофильный эзофагит ремиссия достигается с помощью терапии ингибиторами протонной помпы [43].
- Диетические рекомендации даются после идентификации пищевого или воздушного аллергена.
- Если специфический аллерген не выявлен, может быть назначена диета с исключением шести видов пищи.
- Стандартные рекомендации по фармакологической терапии эозинофильного эзофагита включают местные кортикостероиды и антагонисты лейкотриена [44,45].
- Дилатация пищевода у пациентов с сочетанными стриктурами и кольцами безопасна (с уровнем истинной перфорации менее 1%) и эффективна (дисфагия уменьшается на 1 – 2 года более чем в 90% случаев) [46,47].
3.3 Каскады ведения
Таблицы 7–9 показывают альтернативные варианты ведения в ситуациях ограниченных, средних и обширных ресурсов.
Таблица 7 Каскад: варианты ведения орофарингеальной дисфагии

Таблица 8 Каскад: варианты ведения пищеводной дисфагии

ИПП, ингибиторы протонной помпы.
Таблица 9 Каскад: варианты ведения ахалазии

4. Ссылки
Общие ссылки
Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc 2012;76:1224–37.
Bohm ME, Richter JE. Review article: oesophageal dilation in adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2011;33:748–57.
Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–20.
Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157–64.
Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–9.
Список ссылок
- Ginsberg GG. Food bolus impaction. Gastroenterol Hepatol 2007;3:85–6.
- Hila A, Castell D. Upper gastrointestinal disorders. In: Hazzard W, Blass J, Halter J, Ouslander J, Tinetti ME, editors. Principles of geriatric medicine and gerontology. 5th ed. New York: McGraw-Hill Professional; 2003: 613–40.
- Shamburek RD, Farrar JT. Disorders of the digestive system in the elderly. N Engl J Med 1990;322:438–43.
- Hinchey JA, Shephard T, Furie K, Smith D, Wang D, Tonn S, et al. Formal dysphagia screening protocols prevent pneumonia. Stroke J Cereb Circ 2005;36:1972–6.
- Donovan NJ, Daniels SK, Edmiaston J, Weinhardt J, Summers D, Mitchell PH, et al. Dysphagia screening: state of the art: invitational conference proceeding from the State-of-the-Art Nursing Symposium, International Stroke Conference 2012. Stroke J Cereb Circ 2013;44:e24–31.
- Kalf JG, de Swart BJM, Bloem BR, Munneke M. Prevalence of oropharyngeal dysphagia in Parkinson’s disease: a meta-analysis. Parkinsonism Relat Disord 2012;18:311–5.
- Nicaretta DH, Rosso AL, Mattos JP de, Maliska C, Costa MMB. Dysphagia and sialorrhea: the relationship to Parkinson’s disease. Arq Gastroenterol 2013;50:42–9.
- Atmatzidis K, Papaziogas B, Pavlidis T, Mirelis C, Papaziogas T. Plummer–Vinson syndrome. Dis Esophagus 2003;16:154–7.
- Holland G, Jayasekeran V, Pendleton N, Horan M, Jones M, Hamdy S. Prevalence and symptom profiling of oropharyngeal dysphagia in a community dwelling of an elderly population: a selfreporting questionnaire survey. Dis Esophagus 2011;24:476–80.
- Turley R, Cohen S. Impact of voice and swallowing problems in the elderly. Otolaryngol Head Neck Surg 2009;140:33–6.
- Lin LC, Wu SC, Chen HS, Wang TG, Chen MY. Prevalence of impaired swallowing in institutionalized older people in Taiwan. J Am Geriatr Soc 2002;50:1118–23.
- United States. Congress. House. Resolution expressing the sense of the Congress that a National Dysphagia Awareness Month should be established. 110th Congress. 2nd session. H. Con. Res. 195 (2008). Washington, DC: United States Government Printing Office, 2008. Available at: http://thomas.loc.gov/cgi-bin/query/z?c110:H.CON.RES.195:.
- Kidambi T, Toto E, Ho N, Taft T, Hirano I. Temporal trends in the relative prevalence of dysphagia etiologies from 1999–2009. World J Gastroenterol 2012;18:4335–41.
- Rutegård M, Lagergren P, Nordenstedt H, Lagergren J. Oesophageal adenocarcinoma: the new epidemic in men? Maturitas 2011;69:244–8.
- Ronkainen J, Talley NJ, Aro P, Storskrubb T, Johansson SE, Lind T, et al. Prevalence of oesophageal eosinophils and eosinophilic oesophagitis in adults: the population-based Kalixanda study. Gut 2007;56:615–20.
- Hruz P, Straumann A, Bussmann C, Heer P, Simon HU, Zwahlen M, et al. Escalating incidence of eosinophilic esophagitis: a 20-year prospective, population-based study in Olten County, Switzerland. J Allergy Clin Immunol 2011;128:1349–50.
- Zhang HZ, Jin GF, Shen HB. Epidemiologic differences in esophageal cancer between Asian and Western populations. Chin J Cancer 2012;31:281–6.
- Ronkainen J, Agréus L. Epidemiology of reflux symptoms and GORD. Best Pract Res Clin Gastroenterol 2013;27:325–37.
- Matsuda NM, Miller SM, Evora PRB. The chronic gastrointestinal manifestations of Chagas disease. Clinics (São Paulo, Brazil) 2009;64:1219–24.
- Blackwell Z, Littlejohns P. A review of the management of dysphagia: a South African perspective. J Neurosci Nurs 2010;42:61–70.
- National Stroke Foundation. Clinical guidelines for stroke management 2010. Melbourne: National Stroke Foundation, 2010: 78–95.
- Scharitzer M, Pokieser P, Schober E, Schima W, Eisenhuber E, Stadler A, et al. Morphological findings in dynamic swallowing studies of symptomatic patients. Eur Radiol 2002;12:1139–44.
- Barkhausen J, Goyen M, von Winterfeld F, Lauenstein T, Arweiler-Harbeck D, Debatin JF. Visualization of swallowing using real-time TrueFISP MR fluoroscopy. Eur Radiol 2002;12:129–33.
- Ramsey DJC, Smithard DG, Kalra L. Early assessments of dysphagia and aspiration risk in acute stroke patients. Stroke J Cereb Circ 2003;34:1252–7.
- Pikus L, Levine MS, Yang YX, Rubesin SE, Katzka DA, Laufer I, et al. Videofluoroscopic studies of swallowing dysfunction and the relative risk of pneumonia. AJR Am J Roentgenol 2003;180:1613–6.
- Perlman AL, Witthawaskul W. Real-time remote telefluoroscopic assessment of patients with dysphagia. Dysphagia 2002;17:162–7.
- Omari TI, Dejaeger E, van Beckevoort D, Goeleven A, Davidson GP, Dent J, et al. A method to objectively assess swallow function in adults with suspected aspiration. Gastroenterology 2011;140:1454–63.
- Chang YC, Chen SY, Lui LT, Wang TG, Wang TC, Hsiao TY, et al. Dysphagia in patients with nasopharyngeal cancer after radiation therapy: a videofluoroscopic swallowing study. Dysphagia 2003;18:135–43.
- Katz PO, Knuff TE, Benjamin SB, Castell DO. Abnormal esophageal pressures in reflux esophagitis: cause or effect? Am J Gastroenterol 1986;81:744–6.
- Spechler SJ. AGA technical review on treatment of patients with dysphagia caused by benign disorders of the distal esophagus. Gastroenterology 1999;117:233–54.
- Ott DJ. Radiographic techniques and efficacy in evaluating esophageal dysphagia. Dysphagia 1990;5:192–203.
- Cichero J, Nicholson T, Dodrill P. Liquid barium is not representative of infant formula: characterisation of rheological and material properties. Dysphagia 2011;26:264–71.
- Gisel E. Interventions and outcomes for children with dysphagia. Dev Disabil Res Rev 2008;14:165–73.
- Wilkinson TJ, Thomas K, MacGregor S, Tillard G, Wyles C, Sainsbury R. Tolerance of early diet textures as indicators of recovery from dysphagia after stroke. Dysphagia 2002;17:227–32.
- Pelletier CA, Lawless HT. Effect of citric acid and citric acid-sucrose mixtures on swallowing in neurogenic oropharyngeal dysphagia. Dysphagia 2003;18:231–41.
- Marik PE, Kaplan D. Aspiration pneumonia and dysphagia in the elderly. Chest 2003;124:328–36.
- Ickenstein GW, Kelly PJ, Furie KL, Ambrosi D, Rallis N, Goldstein R, et al. Predictors of feeding gastrostomy tube removal in stroke patients with dysphagia. J Stroke Cerebrovasc Dis 2003;12:169–74.
- Gervais M, Dorion D. Quality of life following surgical treatment of oculopharyngeal syndrome. J Otolaryngol 2003;32:1–5.
- Mann NS. Single dilation of symptomatic Schatzki ring with a large dilator is safe and effective. Am J Gastroenterol 2001;96:3448–9.
- Dumon JF, Meric B, Sivak MV, Fleischer D. A new method of esophageal dilation using Savary-Gilliard bougies. Gastrointest Endosc 1985;31:379–82.
- Pouderoux P, Verdier E, Courtial P, Bapin C, Deixonne B, Balmès JL. Relapsing cardial stenosis after laparoscopic nissen treated by esophageal stenting. Dysphagia 2003;18:218–22.
- Dellon ES. Diagnosis and management of eosinophilic esophagitis. Clin Gastroenterol Hepatol 2012;10:1066–78.
- Molina-Infante J, Katzka DA, Gisbert JP. Review article: proton pump inhibitor therapy for suspected eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;37:1157–64.
- Straumann A, Conus S, Degen L, Frei C, Bussmann C, Beglinger C, et al. Long-term budesonide maintenance treatment is partially effective for patients with eosinophilic esophagitis. Clin Gastroenterol Hepatol 2011;9:400–9.
- Ali MA, Lam-Himlin D, Voltaggio L. Eosinophilic esophagitis: a clinical, endoscopic, and histopathologic review. Gastrointest Endosc 2012;76:1224–37.
- Bohm ME, Richter JE. Review article: oesophageal dilation in adults with eosinophilic oesophagitis. Aliment Pharmacol Ther 2011;33:748–57.
- Moawad FJ, Cheatham JG, DeZee KJ. Meta-analysis: the safety and efficacy of dilation in eosinophilic oesophagitis. Aliment Pharmacol Ther 2013;38:713–20.
















