Данные практические рекомендации Всемирной Гастроэнтерологической Организации (ВГО) по «Дезинфекции эндоскопа» предназначены для использования работниками здравоохранения и профессионалами, вовлеченными в использование, очистку, сушку и уход за эндоскопами, и также направлены на поддержку национальных обществ, официальных организаций и индивидуальных отделений эндоскопии в развитии локальных стандартов и протоколов для повторной обработки эндоскопов.
Данные практические рекомендации ВГО представляют собой результат систематического процесса развития для достижения экспертного консенсуса, основанного на данных медицинской и научной литературы, уже существующих практических рекомендаций и (региональных) стандартах наилучшей практики. Обновление касается недавних вспышек инфекции мультилекарственно-резистентных организмов после эндоскопии и предлагает меры по уменьшению риска развития таких вспышек. Рекомендации основаны на консенсусных решениях международной мультидисциплинарной рабочей группы с обширным опытом в разработке национальных и международных практических рекомендаций по обработке эндоскопов, микробиологии, уходе за больными и гастроэнтерологии; и включают в себя проблему биопленок и обработку эндоскопов.
1.1 Практические рекомендации или стандарты
Предоставление безопасных и эффективных эндоскопических услуг обеспечивается дублирующимися национальными и международными стандартами, включающими дизайн и штатную укомплектованность учреждений, автоматические репроцессоры гибких эндоскопов, дезинфицирующие средства, качество воды и сушильные кабинеты.
Внедрение соответствующих стандартов должно следовать надлежащей производственной практике (GMP). GMP – это набор установлений, кодов и практических рекомендаций процесса производства — в данном случае, обработке эндоскопа — направленного на достижение высокого уровня дезинфекции, что включает в себя как сам процесс, так и контроль качества. GMP используется во всем мире для контроля и управления производством и контроля качества фармацевтических продуктов и эволюционировала за последние 60 лет в ответ на многочисленные широко известные проблемы в фармацевтической индустрии [1].
Инструкции по повторной обработке часто называются “рекомендациями”, но, на самом деле, представляют собой технический стандарт, который описывает минимальные приемлемые действия для повторной обработки для достижения высококачественной дезинфекции эндоскопов. Медицинские практические рекомендации обычно освещают узкую клиническую проблему с использованием популяционных данных — часто результатов рандомизированных исследований — для помощи в ведении индивидуального пациента. Рандомизированные исследования проводятся в специфических популяциях, и клиницисты должны сами решать применимы ли практические рекомендации к их конкретному пациенту [2].
Стандарты более широки в применении и охватывают спецификации и процедуры, направленные на то, чтобы продукты, услуги и системы были безопасными, надежными и последовательно использовались по своему предназначению. Поддерживающие стандарт доказательства основываются на научных, технологических данных и на опыте. Рандомизированные исследования в данной ситуации и в специфической популяции проводятся редко. Стандарты, регулирующие репроцессинг, основываются на научных данных и часто валидируются измерениями эффективности на моделях с искусственными почвами или с известным бактериальным материалом. Техника очистки, дезинфекции, сушки и микробиологических исследований формирует базис стандартов повторной обработки, актуальный для всех стран.
Стандарты описывают минимальные приемлемые действия.
Оба термина, “практические рекомендации” и “стандарты”, используются для описания инструкций по повторной обработке эндоскопа [3,4].
1.2 Общие принципы повторной обработки эндоскопа
Самый важный этап в обработке эндоскопа – это скрупулезная ручная очистка перед дезинфекцией. Если очистка была не адекватной, дезинфекция будет неэффективной [5–7].
Ручная очистка должна проводиться работником, знакомым с устройством эндоскопа и владеющим техникой очистки. Очистка должна быть начата сразу после использования эндоскопа, что бы биологический материал не успел высохнуть и затвердеть. Должны применяться соответствующие детергенты и чистящие материалы, в частности, щетки соответствующего диаметра для каждого канала эндоскопа. Вслед за очисткой должно быть проведено тщательное промывание инструмента от остатков биологического материала и детергентов перед дезинфекцией.
1.2.1 Ручная очистка
Предварительно: сразу после каждой процедуры, с эндоскопом, еще подключенным к источнику питания, необходимо протереть внешнюю поверхность инструмента безворсовой одноразовой тканью. Поместить дистальный конец эндоскопа в раствор низкопенного медицинского моющего средства и промыть все каналы, включая биопсийный/аспирационный канал. Промыть детергентом воздушные/водные каналы. Промыть все каналы, включая дополнительный канал подачи воды (jet channel) (если имеется), водой, затем продуть, согласно инструкциям производителя. Промывание воздушных/водяных каналов детергентом может потребовать применения специального клапана.
Отсоединить эндоскоп от источника питания и переместить его в помещение для чистки в закрытом контейнере, который предохраняет от загрязнения окружающей среды из-за возможных капель или протечек, а также ясно указывает на наличие в нем необработанного эндоскопа.
Очень важно, чтобы эндоскоп не высох перед дальнейшей очисткой, поскольку удаление органического материала станет сложным или вообще невозможным. Эндоскопы должны обрабатываться без задержки в течение 30 минут.
Перед дальнейшей обработкой должна быть проведена проверка на наличие протечек для того чтобы убедиться в сохранении целостности всех каналов. Должны быть сняты все клапаны и кнопки и проведен тест на наличие утечек по инструкции производителя.
Очистить щеткой кнопки и клапана, особое внимание уделяя внутренним поверхностям, и провести дезинфекцию высокого уровня или стерилизацию, согласно оригинальным инструкциям производителя.
Поместить эндоскоп в таз с раствором моющего средства в «грязной» секции помещения для деконтаминации и вымыть наружную поверхность инструмента. Должен использоваться низкопенный медицинский детергент в соответствующем разведении, в соответствии с инструкциями производителя. Все доступные секции аспирационного биопсийного канала должны быть обработаны щеткой, в соответствии с инструкциями производителя. Каждый канал должен обрабатываться щеткой до полного удаления остатков биологического материала. Оконечник и ручки эндоскопа, ложе клапанов также обрабатываются щеткой. Чистящие адаптеры должны быть подсоединены и каналы промыты моющим средством в течение того времени, указанного для данного детергента.
Эндоскоп необходимо промыть детергентом из таза, затем промыть наружную поверхность холодной проточной водой из-под крана, после этого таз заполняется водой из-под крана, которой промываются каналы с использованием чистящих адаптеров, согласно инструкции изготовителя. Продуть каналы воздухом для удаления воды.
1.2.2 Дезинфекция
Дезинфекция высокого уровня проводится в автоматическом репроцессоре для гибких эндоскопов (AFER), который должен соответствовать принятому национальному стандарту, или быть одобренным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). AFER может иметь или может не иметь автоматического цикла очистки, а также цикла дезинфекции. Все коннекторы должны быть специфичны для каждой модели эндоскопа. В начале и по завершении цикла убедитесь, что все каналы подсоединены. Отсоединяемые компоненты, включая воздушный/водяной и аспирационный клапаны, могут быть стерилизованы паром или быть очищены вместе с эндоскопом, если возможность очистки и/или дезинфекции таких съемных компонентов подтверждена изготовителем AFER.
После дезинфекции высокого уровня эндоскоп промывается в AFER водой, очищенной от бактерий с помощью субмикронных фильтров. Качество воды должно регулярно проверяться.
Другим вариантом является ручная дезинфекция высокого уровня, которая может быть эффективна, если проводится опытным персоналом, имеющим соответствующие средства личной защиты. Эндоскоп помещается в дезинфицирующий раствор с заполнением всех каналов. Кнопки и клапаны также погружаются в дезинфицирующий раствор. Инструмент замачивается требуемое время при требуемой температуре и концентрации раствора, согласно спецификациям изготовителя раствора.
Удалить дезинфицирующее средство из всех каналов с помощью струи воздуха, промыть наружную поверхность эндоскопа и все каналы объемом обеззараженной воды, требуемым для специфического дезинфицирующего средства, для удаления всех его следов.
1.2.3 Сушка
После каждой процедуры эндоскопы должны быть высушены и вода из каналов удалена с помощью воздушного компрессора, а затем каналы должны быть промыты этиловым спиртом и также высушены воздушной струей. Промывание алкоголем ускоряет процесс высыхания, а алкоголь также служит полезным дополнением к дезинфекции за счет своего бактерицидного эффекта [8].
В некоторых странах (Франция, Великобритания) применение алкоголя может быть запрещено из-за возможности развития варианта болезни Крейцфельдта-Якоба (БКЯ).
Затем эндоскоп помещается в сушильный шкаф для дополнительной сушки с помощью тока воздуха.
Если эндоскоп используется нечасто, то логичным представляется его отдельное хранение, в вертикальном положении в специальном шкафу, а не в вытяжном шкафу для хранения/сушки. Такой эндоскоп должен быть повторно обработан перед следующим его использованием у пациента. Перед размещением в шкафу эндоскопы должны быть полностью высушены.
1.2.4 Аксессуары
Емкости для воды должны быть заменены после каждой эндоскопической процедуры и стерилизованы паром. Емкости заполняются стерильной водой непосредственно перед использованием.
1.2.5 Документация
Все принципиальные этапы обработки эндоскопа должны быть задокументированы для контроля над качеством и возможной проверки.
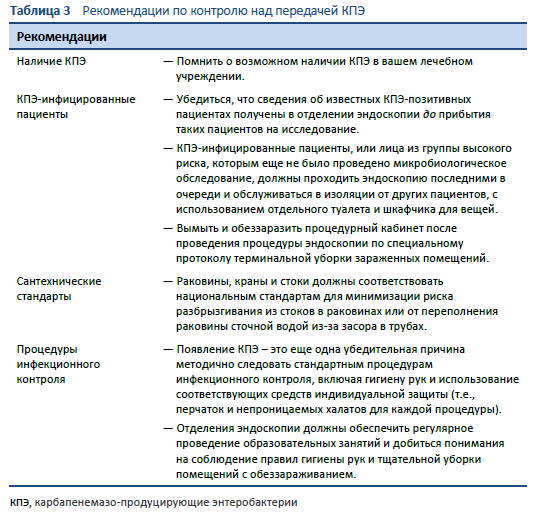
Во время вспышек инфекции МЛРО после эндоскопии пациенты могут колонизироваться бактериями и первично не иметь клинической симптоматики, а серьезные инфекционные признаки развиваются только спустя недели или месяцы, с показателями смертности достигающими 40% [36,52].
Часто единственный штамм КПЭ передается через один эндоскоп множество раз, несмотря на обработку. Такая эпидемиология лучше всего объясняется наличием на эндоскопе биопленки, которая защищает бактерии от очистки и дезинфекции и служит резервуаром для передачи инфекции.
5.1 Биопленка
В 1999 г. Центры по Контролю над Заболеваемостью и Профилактики (CDC) сообщили о вспышке инфекции карбапенемазо-продуцирующей Pseudomonas aeruginosa, последовавшей после проведения бронхоскопии. Был сделан вывод, что ответственность за эту вспышку лежит на формировании биопленки в трудно досягаемых для очитки узких каналах эндоскопа [53]. В последующих исследованиях поверхности каналов эндоскопа изучались с помощью сканирующей электронной микроскопии и было подтверждено наличие биопленки, часто располагающейся в поверхностных дефектах [32]. Другие исследования также выявили биопленку в каналах эндоскопа [54–56] и в эндоскопах, участвовавших в распространении инфекции при вспышках [57–59].
Биопленка – это конгломерат бактерий, прикрепившихся к поверхности и друг к другу с помощью экстрацеллюлярной полисахаридной матрицы. Бактерии, живущие в биопленке, обладают качествами, отличающими их от бактерий того же штамма, находящихся в свободном состоянии (планктонных). Бактерии, находящиеся в биопленке, резистентны к дезинфицирующим средствам, применяемым в рекомендованных для обработки концентрациях [60]. Планктонные КПЭ погибают под действием стандартных дезинфицирующих средств в течение 1 минуты, что предоставляет им значительный резерв безопасности [61]. Тем не менее, матрица биопленки ограничивает диффузию дезинфицирующих средств, а множественные клеточные слои и та же матрица не позволяют средствам проникнуть внутрь биопленки [62]. Стандартные концентрации дезинфицирующих средств не способны уничтожить бактерии внутри биопленки [63]. Бактерии в фиксированной биопленке, которая скапливается в дефектах поверхности каналов эндоскопа, также защищены остатками органических материалов и белковыми сшивками, что делает их более трудными для уничтожения при стандартной обработке [31,55]. Текущие параметры повторной обработки основаны на данных, полученных на моделях с использование искусственных почв и планктонных бактерий в большей степени, чем на моделях бактерий, находящихся в биопленках.
Биопленка действует как резервуар для бактерий, прикрепленный к поверхности канала эндоскопа, и, при благоприятных условиях, бактерии в биопленке могут размножаться, отсоединяться, восстанавливая свое планктонное состояние, и передаваться пациенту во время эндоскопии [31]. Влажность и запас питательных веществ способствует росту биопленки и высвобождению планктонных бактерий.
В прошлом роль влажности в стимуляции роста биопленки во время хранения эндоскопа и важность проведения полного высушивания после обработки недооценивалась. Имеющиеся на настоящий момент доказательства показывают, что в 95% эндоскопов сохраняется видимая влажность в каналах после промывания алкоголем в AFER, 3-минутного сушильного цикла и ночного хранения в стандартном шкафу [64]. Сохранение эндоскопа свободным от влажности — особенно каналов во время хранения — должно быть приоритетным.
Биопленка охотно формируется в дефектах эндоскопа, часто в продольных следах износа в биопсийных каналах, и ее сложно или невозможно удалить при стандартной обработке [31,32,55,65]. Мультицентровое исследование готовых к использованию эндоскопов выявило дефекты во всех 45 проверенных аппаратах [66]. Изучение каналов с помощью бороскопа обычно выявляет скрытые дефекты поверхности [66–68]. Эндоскопы должны проходить регулярную проверку для обнаружения и исправления макроскопических дефектов с уменьшением частоты скрытых дефектов для поддержания гладкого, пригодного для чистки, состояния поверхности каналов [6,37]. Исследование Verfallie et al. дуоденоскопа, участвовавшего в возникновении вспышки инфекции, показало, что важной проблемной областью в дуоденоскопе являются О-образные кольца; они, также как и каналы, должны заменяться ежегодно [36]. Для других эндоскопов может требоваться менее частая замена каналов, возможно раз в 1–2 года в зависимости от рабочей нагрузки.
5.2 Дуоденоскопы
Дуоденоскопы трудно чистить и дезинфицировать. В дополнение к их сложному дизайну, такие факторы, как характеристики пациентов, направляемых на ЭРХПГ, и проводимые вмешательства, также вносят свою лепту в риск колонизации и последующее развитие инфекции бактериями, передающимися во время процедуры.
Частота заражения дуоденоскопов, если судить по положительным результатам посева культур, сходна с частотой для гастроскопов и колоноскопов [18–21]. Таким образом, доминантными факторами в большей частоте возникновения вспышек инфекции после ЭРХПГ являются характеристики пациента и производимые вмешательства.
Риску возникновения вспышек инфекции, а также улучшению процесса обработки всех эндоскопов, посвящены специфические изменения в рекомендациях по очистке и дезинфекции дуоденоскопов. Важным улучшением для обработки дуоденоскопов являются обновленные протоколы от изготовителей. Обзор базы данных обеспечения качества 4307 культур дуоденоскопа показал, что внедрение новых протоколов очистки значительно снизило частоту положительных исследований культур [69].
5.3 Сушка
Сушка, как этап обработки эндоскопа, часто игнорируется или выполняется не в полном объеме; часто при ней наблюдаются человеческие ошибки [37]. Исследование обработки эндоскопов, проведенное в США, и охватывавшее 249 эндоскопических отделений, проводящих ЭРХПГ, показало что 52% центров не соблюдают международные практические рекомендации и не применяют сжатый воздух для сушки эндоскопов [70]. Практические рекомендации противоречат друг другу и не всегда уточняют параметры для адекватной сушки [71]. Недавно проведенные исследования показали наличие остаточной жидкости в 95% каналов эндоскопов после обработки и сушки, что дает основания предположить необходимость улучшения практических рекомендаций [55,64].
Биопленкам для роста нужна влажность. Alfa и Sitter, в ключевой статье продемонстрировали, что если оставлять дуоденоскопы влажными после обработки, отмечается быстрый рост штаммов Pseudomonas и Acinetobacter [72]. Сушка в течение 10 минут сжатым воздухом предотвращала этот рост во всех исследованных дуоденоскопах. Применение промывания алкоголем, за которым следовала кратковременная сушка сжатым воздухом закончилось вспышками инфекции Pseudomonas после ЭРХПГ в 1980-е гг. [73]. Более свежие исследования подтвердили, что промывание алкоголем, за которым следует 10-минутная сушка сжатым воздухом, более эффективно, чем применение промывания с сушкой в течение более короткого, вариабельного времени [66,74].
В практически рекомендациях Ассоциации Операционных Медицинских Сестер (AORN) [4] отмечено, что эндоскопы должны храниться в сушильных шкафах и сделано заявление о том, что “Собранные доказательства показывают, что оптимальное хранение гибких эндоскопов способствует сушке, снижает потенциал для заражения и обеспечивает защиту от загрязнений внешней среды”.
Эта рекомендация поддерживается результатами исследования культур на готовых к использованию эндоскопах, включая дуоденоскопы, гастроскопы, колоноскопы и эхоэндоскопы, которое показало, что использование сушильных шкафов значительно снижало риск заражения эндоскопов [75]. В прямом сравнении, сушильные шкафы с вытяжкой значительно быстрее и выражено уменьшали микробный рост, чем стандартные шкафы для хранения эндоскопов [76].
5.4 Симетикон
Симетикон – это основанный на силиконе полимер, используемый в эндоскопии для улучшения видимости. Рандомизированные исследования подтверждают, что его применение уменьшает количество пузырей и улучшает видимость. Тем не менее, симетикон является водонерастворимым веществом, и в 2009 году компания Olympus предупредила, что симетикон трудно удалим при стандартной обработке эндоскопов [77]. В 2016 году, van Stiphout et al. сообщили, что при добавлении симетокона к воде, поступающей по водному каналу колоноскопа, в коннекторе и канале формируются кристаллические отложения [78]. Последующее исследование подтвердило, что различные концентрации симетокона, смываемые по биопсийному/аспирационному каналу формируют остаток, который полностью не удаляется при стандартной обработке [79]. Остаточный симетикон может мешать процессу сушки и увеличивать риск формирования биопленки, что может, в свою очередь, привести к выживанию микробов при дезинфекции высокого уровня и стерилизации. В июне 2018 г., Olympus рекомендовал отказаться от использования симетикона и других водонерастворимых субстанций [80]. Недавняя журнальная редакционная статья отмечает, что Pentax и FujiFilm также не рекомендует использовать симетикон в их эндоскопах, и авторы обещают, что вскоре будут сформированы новые инструкции изготовителей эндоскопов [81].
5.5 Тропические инфекции
Существует очень мало доказательств наличия риска передачи паразитарных инфекций во время желудочно-кишечного эндоскопического исследования. Для того чтобы стать источником инфекции, большинству паразитических организмов требуется прохождение жизненного цикла, которое занимает определенное время, поэтому заражение не может возникнуть сразу. Большинство потенциально инфекционных паразитов не может выжить при обработке эндоскопа.
В целом, считается, что нет риска заражения гельминтами, нематодами, платигельминтами, Anisakis, или печеночными двуустками, такими как Fasciola hepatica, но имеется одно сообщение о четырех случаях стронгилоидозного эзофагита, обусловленных использованием одно и того же гастроскопа [82]. Тем не менее, возникают определенные опасения в отношении риска заражения Giardia lamblia, Cryptosporidium и амебами.
5.6 Заключение
Техника обработки развивается. Данные новых исследований — включая базовые, клинические и рандомизированные, проведенные в ответ на сообщения о вспышках инфекции КПЭ — уже опубликованы. Изготовители эндоскопов продолжают улучшать их дизайн и валидизируют новые инструкции по обработке. На рынке появились новые технологии сушки и очистки. Профессиональные общества публикуют обновленные версии практических рекомендаций по обработке эндоскопов в ответ на поток новой информации.
Данные практические рекомендации, наряду с другими, опубликованными в последнее время, советуют стационарным медицинским создавать мультидисциплинарные комитеты с разнообразными интересами и опытом для восприятия поступающей информации, развивать, внедрять и – что очень важно –регулярно обновлять практические рекомендации по обработке, соответствующие ресурсам учреждения и подбору пациентов.
Эффективная обработка – это ключ к безопасности пациента при эндоскопии.
1. Patel KT, Chotai NP. Pharmaceutical GMP: past, present, and future—a review. Pharmazie. 2008;63(4):251–5.
2. Evidence-Based Medicine Working Group. Evidence-based medicine. A new approach to teaching the practice of medicine. JAMA. 1992;268(17):2420–5.
3. Society of Gastroenterology Nurses and Associates (SGNA). Standards and position statements [Internet] [Internet]. Chicago, IL: Society of Gastroenterology Nurses and Associates (SGNA); 2019 [cited 2018 Jan 18]. Available from: https://www.sgna.org/Practice/Standards-Practice-Guidelines
4. Association for periOperative Registered Nurses (AORN). Guidelines for perioperative practice [Internet]. Denver, CO: AORN, Inc.; 2019. Available from: https://www.aornbookstore.org/Product/Detail/MAN019
5. Gastroenterological Society of Australia (GESA). Infection control in endoscopy [Internet] [Internet]. Melbourne: Gastroenterological Society of Australia (GESA); 2010 [cited 2018 Jan 18]. Available from: http://www.gesa.org.au/resources/infection-control-in-endoscopy/
6. Kenters N, Huijskens E, Meier C, Voss A. Infectious diseases linked to cross-contamination of flexible endoscopes. Endosc Int Open. 2015;3(4):E259–65.
7. Alfa MJ. Current issues result in a paradigm shift in reprocessing medical and surgical instruments. Am J Infect Control. 2016 May;44(5):e41–5.
8. Kovacs BJ, Chen YK, Kettering JD, Aprecio RM, Roy I. High-level disinfection of gastrointestinal endoscopes: are current guidelines adequate? Am J Gastroenterol. 1999;94(6):1546–50.
9. Hayes, Inc. FDA Advisory Panel offers recommendations on procedures for reprocessing duodenoscopes [press release] [Internet]. Dallas, TX: Hayes, Inc.; 2015 [cited 2018 Feb 7]. Available from: https://www.hayesinc.com/hayes/resource-center/news-service/HNS-20150420-49/
10. U.S. Food and Drug Administration (FDA). Division of Industry and Consumer Education (DICE). Infections associated with reprocessed flexible bronchoscopes: FDA safety communication [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Feb 9]. Available from: http://wayback.archive-it.org/7993/20170722213119/https://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm462949.htm
11. Naas T, Cuzon G, Babics A, Fortineau N, Boytchev I, Gayral F, et al. Endoscopy-associated transmission of carbapenem-resistant Klebsiella pneumoniae producing KPC-2 beta-lactamase. J Antimicrob Chemother. 2010;65(6):1305–6.
12. Bajolet O, Ciocan D, Vallet C, de Champs C, Vernet-Garnier V, Guillard T, et al. Gastroscopy-associated transmission of extended-spectrum beta-lactamase-producing Pseudomonas aeruginosa. J Hosp Infect. 2013 Apr;83(4):341–3.
13. Orsi GB, García-Fernández A, Giordano A, Venditti C, Bencardino A, Gianfreda R, et al. Risk factors and clinical significance of ertapenem-resistant Klebsiella pneumoniae in hospitalised patients. J Hosp Infect. 2011;78(1):54–8.
14. Koo VSW, O’Neill P, Elves A. Multidrug-resistant NDM-1 Klebsiella outbreak and infection control in endoscopic urology. BJU Int. 2012;110(11 Pt C):E922-926.
15. Tumbarello M, Spanu T, Sanguinetti M, Citton R, Montuori E, Leone F, et al. Bloodstream infections caused by extended-spectrum-beta-lactamase-producing Klebsiella pneumoniae: risk factors, molecular epidemiology, and clinical outcome. Antimicrob Agents Chemother. 2006;50(2):498–504.
16. Orsi GB, Bencardino A, Vena A, Carattoli A, Venditti C, Falcone M, et al. Patient risk factors for outer membrane permeability and KPC-producing carbapenem-resistant Klebsiella pneumoniae isolation: results of a double case-control study. Infection. 2013;41(1):61–7.
17. Voor In ’t Holt AF, Severin JA, Hagenaars MBH, de Goeij I, Gommers D, Vos MC. VIM-positive Pseudomonas aeruginosa in a large tertiary care hospital: matched case-control studies and a network analysis. Antimicrob Resist Infect Control. 2018;7:32.
18. Bisset L, Cossart YE, Selby W, West R, Catterson D, O’Hara K, et al. A prospective study of the efficacy of routine decontamination for gastrointestinal endoscopes and the risk factors for failure. Am J Infect Control. 2006;34(5):274–80.
19. Brandabur JJ, Leggett JE, Wang L, Bartles RL, Baxter L, Diaz GA, et al. Surveillance of guideline practices for duodenoscope and linear echoendoscope reprocessing in a large healthcare system. Gastrointest Endosc. 2016;84(3):392-399.e3.
20. Saliou P, Héry-Arnaud G, Le Bars H, Payan C, Narbonne V, Cholet F, et al. Evaluation of current cleaning and disinfection procedures of GI endoscopes. Gastrointest Endosc. 2016;84(6):1077.
21. Jones D. [Australia’s microbiological surveillance experience.]. In: U.S. Food and Drug Administration (FDA). Center for Devices and Radiological Health. Medical Devices Advisory Committee. Gastroenterology and Urology Devices Panel, editor. [Transcript of meeting held on May 14, 2015, Silver Spring, Maryland] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2019 May 31]. p. 142–5. Available from: https://wayback.archive-it.org/7993/20170113091355/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/UCM451164.pdf
22. Kelly CR, Kahn S, Kashyap P, Laine L, Rubin D, Atreja A, et al. Update on fecal microbiota transplantation 2015: indications, methodologies, mechanisms, and outlook. Gastroenterology. 2015;149(1):223–37.
23. Cammarota G, Ianiro G, Tilg H, Rajilić-Stojanović M, Kump P, Satokari R, et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut. 2017;66(4):569–80.
24. Rutala WA. ERCP scopes: a need to shift from disinfection to sterilization? In: U.S. Food and Drug Administration (FDA). Center for Devices and Radiological Health. Medical Devices Advisory Committee. Gastroenterology and Urology Devices Panel, editor. [Transcript of meeting held on May 15, 2015, Silver Spring, Maryland] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Mar 6]. p. 307–18. Available from: https://wayback.archive-it.org/7993/20170113091400/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/UCM451165.pdf
25. U.S. Food and Drug Administration (FDA). Gastroenterology-Urology Devices Panel. 2015 materials of the Gastroenterology-Urology Devices Panel [Internet] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Feb 9]. Available from: https://wayback.archive-it.org/7993/20170112002249/http:/www.fda.gov/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/ucm445590.htm
26. Petersen BT, Cohen J, Hambrick RD, Buttar N, Greenwald DA, Buscaglia JM, et al. Multisociety guideline on reprocessing flexible GI endoscopes: 2016 update. Gastrointest Endosc. 2017;85(2):282-294.e1.
27. Snyder GM, Wright SB, Smithey A, Mizrahi M, Sheppard M, Hirsch EB, et al. Randomized comparison of 3 high-Level disinfection and sterilization procedures for duodenoscopes. Gastroenterology. 2017;153(4):1018–25.
28. U.S. Food and Drug Administration (FDA). Division of Industry and Consumer Education (DICE). Supplemental measures to enhance duodenoscope reprocessing: FDA safety communication [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Feb 9]. Available from: http://wayback.archive-it.org/7993/20170722150658/https://www.fda.gov/MedicalDevices/Safety/AlertsandNotices/ucm454766.htm
29. Thaker AM, Kim S, Sedarat A, Watson RR, Muthusamy VR. Inspection of endoscope instrument channels after reprocessing using a prototype borescope. Gastrointest Endosc. 2018;88(4):612–9.
30. Bartles RL, Leggett JE, Hove S, Kashork CD, Wang L, Oethinger M, et al. A randomized trial of single versus double high-level disinfection of duodenoscopes and linear echoendoscopes using standard automated reprocessing. Gastrointest Endosc. 2018;88(2):306–313.e2.
31. Alfa MJ, Ribeiro MM, da Costa Luciano C, Franca R, Olson N, DeGagne P, et al. A novel polytetrafluoroethylene-channel model, which simulates low levels of culturable bacteria in buildup biofilm after repeated endoscope reprocessing. Gastrointest Endosc. 2017 Sep;86(3):442-451.e1.
32. Pajkos A, Vickery K, Cossart Y. Is biofilm accumulation on endoscope tubing a contributor to the failure of cleaning and decontamination? J Hosp Infect. 2004;58(3):224–9.
33. Roberts CG. The role of biofilms in reprocessing medical devices. Am J Infect Control. 2013;41(5 Suppl):S77-80.
34. U.S. Food and Drug Administration, Centers for Disease Control and Prevention (CDC), American Society for Microbiology (ASM). Duodenoscope surveillance. Sampling and culturing: reducing the risks of infection [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2018 [cited 2018 Mar 7]. 58 p. Available from: https://www.fda.gov/downloads/medicaldevices/productsandmedicalprocedures/reprocessingofreusablemedicaldevices/ucm597949.pdf
35. Weingarten RA, Johnson RC, Conlan S, Ramsburg AM, Dekker JP, Lau AF, et al. Genomic analysis of hospital plumbing reveals diverse reservoir of bacterial plasmids conferring carbapenem resistance. mBio. 2018;9(1):e02011-17.
36. Verfaillie CJ, Bruno MJ, Voor in ’t Holt AF, Buijs JG, Poley J-W, Loeve AJ, et al. Withdrawal of a novel-design duodenoscope ends outbreak of a VIM-2-producing Pseudomonas aeruginosa. Endoscopy. 2015;47(6):493–502.
37. Jung M, Beilenhoff U. Hygiene: the looming Achilles heel in endoscopy. Visc Med. 2016;32(1):21–8.
38. Ling ML, Ching P, Widitaputra A, Stewart A, Sirijindadirat N, Thu LTA. APSIC guidelines for disinfection and sterilization of instruments in health care facilities. Antimicrob Resist Infect Control. 2018;7:25.
39. Murdani A, Kumar A, Chiu H-M, Goh K-L, Jang BI, Khor CJL, et al. WEO position statement on hygiene in digestive endoscopy: focus on endoscopy units in Asia and the Middle East. Dig Endosc. 2017;29(1):3–15.
40. Beilenhoff U, Neumann C, Rey J, Biering H, Blum R, Schmidt V. ESGE-ESGENA guideline for quality assurance in reprocessing: Microbiological surveillance testing in endoscopy. Endoscopy. 2007;39(02):175–81.
41. Chinese Society of Digestive Endoscopy. Consensus of experts on the safe operation of digestive endoscopy centers in China. J Dig Dis. 2016;17(12):790–9.
42. Roberts G, Roberts C, Jamieson A, Grimes C, Conn G, Bleichrodt R. Surgery and obstetric care are highly cost-effective interventions in a sub-Saharan African district hospital: a three-month single-institution study of surgical costs and outcomes. World J Surg. 2016;40(1):14–20.
43. Rennert-May E, Conly J, Leal J, Smith S, Manns B. Economic evaluations and their use in infection prevention and control: a narrative review. Antimicrob Resist Infect Control. 2018;7:31.
44. Bartsch SM, McKinnell JA, Mueller LE, Miller LG, Gohil SK, Huang SS, et al. Potential economic burden of carbapenem-resistant Enterobacteriaceae (CRE) in the United States. Clin Microbiol Infect. 2017;23(1):48.e9-48.e16.
45. Bardossy AC, Zervos J, Zervos M. Preventing hospital-acquired infections in low-income and middle-income countries. Infect Dis Clin North Am. 2016 Sep;30(3):805–18.
46. Association for the Advancement of Medical Instrumentation (AAMI). ANSI/AAMI ST91:2015 Comprehensive guide to flexible and semi-rigid endoscope processing in health care facilities [Internet]. Arlington, VA: Association for the Advancement of Medical Instrumentation; 2015. Available from: https://www.aami.org/productspublications/ProductDetail.aspx?ItemNumber=2477
47. Association for the Advancement of Medical Instrumentation (AAMI). Preventing device-related healthcare-associated infections: issues and outcomes from the September 2016 forum, Medical Technology and HAIs [Internet]. Arlington, VA: Association for the Advancement of Medical Instrumentation (AAMI); 2016 [cited 2018 Feb 7]. 19 p. Available from: https://s3.amazonaws.com/rdcms-aami/files/production/public/FileDownloads/Summits/161227_AAMI_HAI_Forum_Report.pdf
48. International Organization for Standardization (ISO). ISO 9000:2015(en). Quality management systems — fundamentals and vocabulary [Internet]. Geneva: International Organization for Standardization (ISO); 2015 [cited 2018 Jan 18]. Available from: https://www.iso.org/obp/ui/#iso:std:iso:9000:ed-4:v1:en
49. International Organization for Standardization (ISO). ISO 9001:2015. Quality management systems — requirements [Internet]. Geneva: International Organization for Standardization (ISO); 2015 [cited 2018 Jan 18]. Available from: https://www.iso.org/standard/62085.html
50. International Organization for Standardization (ISO). ISO 13485:2016. Medical devices — quality management systems — requirements for regulatory purposes [Internet]. Geneva: International Organization for Standardization (ISO); 2016 [cited 2018 Jan 18]. Available from: https://www.iso.org/standard/59752.html
51. Beilenhoff U, Biering H, Blum R, Brljak J, Cimbro M, Dumonceau J-M, et al. Prevention of multidrug-resistant infections from contaminated duodenoscopes: position statement of the European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Gastroenterology Nurses and Associates (ESGENA). Endoscopy. 2017;49(11):1098–106.
52. Kallen AJ. CDC outbreak investigation. In: U.S. Food and Drug Administration (FDA). Center for Devices and Radiological Health. Medical Devices Advisory Committee. Gastroenterology and Urology Devices Panel, editor. [Transcript of meeting held on May 14, 2015, Silver Spring, Maryland] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Jun 3]. p. 199–210. Available from: https://wayback.archive-it.org/7993/20170113091355/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/UCM451164.pdf
53. Centers for Disease Control and Prevention (CDC). Bronchoscopy-related infections and pseudoinfections—New York, 1996 and 1998. MMWR Morb Mortal Wkly Rep. 1999;48(26):557–60.
54. Wu R-P, Xi H-J, Qi K, Wang D, Nie X, Li Z-S. Correlation between the growth of bacterial biofilm in flexible endoscopes and endoscope reprocessing methods. Am J Infect Control. 2014;42(11):1203–6.
55. Hervé RC, Keevil CW. Persistent residual contamination in endoscope channels; a fluorescence epimicroscopy study. Endoscopy. 2016;48(7):609–16.
56. Herrmann IF, Heeg P, Matteja B, Strahl HM, Werner H-P, Boyce W, et al. Risques et dangers cachés de l’endoscopie, conduite à tenir. Acta Endosc. 2008;38(5):493–502.
57. Buss A, Been M, Borgers R, Stokroos I, Melchers W, Peters F, et al. Endoscope disinfection and its pitfalls — requirement for retrograde surveillance cultures. Endoscopy. 2008;40(04):327–32.
58. Kovaleva J, Meessen N, Peters F, Been M, Arends J, Borgers R, et al. Is bacteriologic surveillance in endoscope reprocessing stringent enough? Endoscopy. 2009;41(10):913–6.
59. Johani K, Hu H, Santos L, Schiller S, Deva AK, Whiteley G, et al. Determination of bacterial species present in biofilm contaminating the channels of clinical endoscopes. Infect Dis Health. 2018;23(4):189–96.
60. Otter JA, Vickery K, Walker JT, deLancey Pulcini E, Stoodley P, Goldenberg SD, et al. Surface-attached cells, biofilms and biocide susceptibility: implications for hospital cleaning and disinfection. J Hosp Infect. 2015;89(1):16–27.
61. Olson J. Medivators. In: U.S. Food and Drug Administration (FDA). Center for Devices and Radiological Health. Medical Devices Advisory Committee. Gastroenterology and Urology Devices Panel, editor. [Transcript of meeting held on May 14, 2015, Silver Spring, Maryland] [Internet]. Silver Spring, MD: U.S. Food and Drug Administration (FDA); 2015 [cited 2018 Jun 3]. p. 69–77. Available from: https://wayback.archive-it.org/7993/20170113091355/http://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/MedicalDevices/MedicalDevicesAdvisoryCommittee/Gastroenterology-UrologyDevicesPanel/UCM451164.pdf
62. Bridier A, Briandet R, Thomas V, Dubois-Brissonnet F. Resistance of bacterial biofilms to disinfectants: a review. Biofouling. 2011;27(9):1017–32.
63. Akinbobola AB, Sherry L, Mckay WG, Ramage G, Williams C. Tolerance of Pseudomonas aeruginosa in in-vitro biofilms to high-level peracetic acid disinfection. J Hosp Infect. 2017 Oct;97(2):162–8.
64. Ofstead CL, Wetzler HP, Johnson EA, Heymann OL, Maust TJ, Shaw MJ. Simethicone residue remains inside gastrointestinal endoscopes despite reprocessing. Am J Infect Control. 2016;44(11):1237–40.
65. da Costa Luciano C, Olson N, Tipple AFV, Alfa M. Evaluation of the ability of different detergents and disinfectants to remove and kill organisms in traditional biofilm. Am J Infect Control. 2016;44(11):e243–9.
66. Ofstead CL, Heymann OL, Quick MR, Eiland JE, Wetzler HP. Residual moisture and waterborne pathogens inside flexible endoscopes: Evidence from a multisite study of endoscope drying effectiveness. Am J Infect Control. 2018;46(6):689–96.
67. Ofstead CL, Doyle EM, Eiland JE, Amelang MR, Wetzler HP, England DM, et al. Practical toolkit for monitoring endoscope reprocessing effectiveness: identification of viable bacteria on gastroscopes, colonoscopes, and bronchoscopes. Am J Infect Control. 2016;44(7):815–9.
68. Ofstead CL, Wetzler HP, Eiland JE, Heymann OL, Held SB, Shaw MJ. Assessing residual contamination and damage inside flexible endoscopes over time. Am J Infect Control. 2016;44(12):1675–7.
69. Higa JT, Choe J, Tombs D, Gluck M, Ross AS. Optimizing duodenoscope reprocessing: rigorous assessment of a culture and quarantine protocol. Gastrointest Endosc. 2018;88(2):223–9.
70. Thaker AM, Muthusamy VR, Sedarat A, Watson RR, Kochman ML, Ross AS, et al. Duodenoscope reprocessing practice patterns in U.S. endoscopy centers: a survey study. Gastrointest Endosc. 2018;88(2):316-322.e2.
71. Kovaleva J. Endoscope drying and its pitfalls. J Hosp Infect. 2017;97(4):319–28.
72. Alfa MJ, Sitter DL. In-hospital evaluation of contamination of duodenoscopes: a quantitative assessment of the effect of drying. J Hosp Infect. 1991 Oct;19(2):89–98.
73. Petersen BT. Duodenoscope reprocessing: risk and options coming into view. Gastrointest Endosc. 2015;82(3):484–7.
74. Barakat MT, Huang RJ, Banerjee S. Comparison of automated and manual drying in the eliminating residual endoscope working channel fluid after reprocessing (with video). Gastrointest Endosc. 2018 Aug 24;
75. Saliou P, Le Bars H, Payan C, Narbonne V, Cholet F, Jézéquel J, et al. Measures to improve microbial quality surveillance of gastrointestinal endoscopes. Endoscopy. 2016;48(8):704–10.
76. Perumpail RB, Marya NB, McGinty BL, Muthusamy VR. Endoscope reprocessing: comparison of drying effectiveness and microbial levels with an automated drying and storage cabinet with forced filtered air and a standard storage cabinet [Epub ahead of print]. Am J Infect Control. 2019 Apr 6;
77. Catalone BJ, Olympus America Inc. Simethicone [letter to customers] [Internet]. 2009 Jun 9 [cited 2019 May 31]; Available from: https://medical.olympusamerica.com/sites/default/files/pdf/SimethiconeCustomerLetter.pdf
78. van Stiphout S, Laros I, van Wezel R, Gilissen L. Crystallization in the waterjet channel in colonoscopes due to simethicone. Endoscopy. 2016;48(S 01):E394–5.
79. Barakat MT, Huang RJ, Banerjee S. Simethicone is retained in endoscopes despite reprocessing: impact of its use on working channel fluid retention and adenosine triphosphate bioluminescence values (with video). Gastrointest Endosc. 2019;89(1):115–23.
80. ECRI Institute. Olympus—flexible endoscopes: manufacturer recommends against use of simethicone/non-water soluble additives — Alert [Internet]. Plymouth Meeting, PA: ECRI Institute; 2018 [cited 2019 Mar 1]. Available from: https://www.ecri.org/Components/Alerts/Pages/login.aspx?Page=AlertDisplay&AId=1635719
81. Visrodia K, Petersen BT. Borescope examination: Is there value in visual assessment of endoscope channels? Gastrointest Endosc. 2018;88(4):620–3.
82. Mandelstam P, Sugawa C, Silvis SE, Nebel OT, Rogers BH. Complications associated with esophagogastroduodenoscopy and with esophageal dilation. Gastrointest Endosc. 1976;23(1):16–9.