1. Resumen
El Helicobacter pylori sigue siendo un importante problema sanitario en todo el mundo, ya que la úlcera péptica y el cáncer gástrico que produce tienen una morbimortalidad considerable.
La carga de la enfermedad recae de forma desproporcionada en las poblaciones con menos recursos. Como ocurre con la mayoría de las enfermedades infecciosas, el mayor impacto en la reducción de esta carga depende de mejoras en las condiciones socioeconómicas que interrumpen la transmisión. Esto se ha observado en muchas regiones del mundo, pero la prevalencia de la infección sigue siendo alta en muchas regiones en las que esa mejora del nivel de vida es lenta.
Mientras tanto, el manejo clínico y las vías de tratamiento óptimas siguen sin resolverse y van cambiando a medida que cambian los patrones de resistencia a los agentes antimicrobianos. A pesar de décadas de investigación y práctica clínica, sigue habiendo grandes retos. La búsqueda de la terapia más eficaz, segura y sencilla es todavía un problema importante para los médicos. Asimismo, sigue sin concretarse la obtención de una vacuna eficaz.
Las directrices clínicas no pocas veces proponen conductas discordantes. Es muy difícil que las directrices resulten pertinentes para poblaciones diferentes que presentan distintos espectros de la enfermedad y tasas de resistencia microbiana y recursos muy diferentes. Dado que los factores locales son fundamentales para determinar el efecto y las estrategias de tratamiento de la infección por H. pylori, es importante que las pautas se basen en los mejores conocimientos disponibles a nivel local, en lugar de limitarse a extrapolarlas de las directrices formuladas en otras regiones, que pueden ser menos aplicables. Es por eso que esta revisión de la guía de la WGO sobre H. pylori utiliza un enfoque de “cascadas” que resume los principios de gestión y ofrece consejos para pautas de diagnóstico y tratamiento pragmáticas, pertinentes y alcanzables, sobre la base de principios clave de tratamiento ya establecidos y utilizando los conocimientos y recursos disponibles a nivel local para orientar la práctica regional.
2. Introducción
El Helicobacter pylori ha sido reconocido como un importante patógeno de la humanidad desde hace casi cuatro décadas. Sin embargo, pese al impacto del tratamiento de los individuos infectados y de la reducción de la transmisión de la infección en las comunidades en las que ha mejorado el nivel socioeconómico, sigue siendo el patógeno bacteriano más frecuente en humanos, y puede que la mitad de la población mundial esté infectada [1]. Por ello, sigue siendo una de las principales causas de morbilidad y mortalidad en todo el mundo.
La infección por H. pylori provoca invariablemente una gastritis crónica activa. En la mayoría de las personas, la infección puede mantenerse clínicamente en silencio durante toda la vida, pero en una minoría importante provoca enfermedades gastroduodenales, particularmente úlcera péptica, cáncer gástrico no cardial y linfoma del tejido linfoide asociado a la mucosa gástrica (MALT). También aumenta el riesgo de ulceración y hemorragia gastroduodenal en pacientes que reciben antiinflamatorios no esteroideos (AINE) como aspirina, y es responsable de los síntomas en un subgrupo de pacientes que presentan dispepsia funcional.
H. pylori se ha estudiado intensamente. Una búsqueda bibliográfica revela más de 45.000 publicaciones. Se sabe ya mucho sobre la epidemiología de la infección, su biología, genética y fisiopatología, la expresión de la enfermedad, su diagnóstico y su tratamiento. Aun así, nuestros conocimientos siguen teniendo importantes lagunas. A pesar de los numerosos estudios epidemiológicos que identifican los factores de riesgo de la infección, sigue sin estar claro cuál es el modo preciso de transmisión. Entre los determinantes de la expresión de la enfermedad que siguen sin conocerse del todo se encuentran muchos aspectos de la interacción entre el patógeno y su hospedero. La fisiopatología de esta interacción es compleja y ha sido descrita en detalle [2,3]. Las vías óptimas de tratamiento clínico en diferentes entornos siguen siendo objeto de debate, y siguen los intentos por perfeccionar las modalidades diagnósticas. La búsqueda del tratamiento más eficaz, seguro y sencillo es aún importante para los clínicos, y el problema de la resistencia antimicrobiana constituye un reto difícil. Aun no se ha determinado cuál es el mejor método de vigilancia de las alteraciones histológicas adversas en la mucosa gástrica, y se trabaja en búsqueda de una vacuna eficaz.
Ha habido muchas revisiones y guías clínicas sobre H. pylori [4-12–12]. Como el campo está cambiando rápidamente, estos documentos de posición necesitan una actualización y revisión periódicas. Además, es muy difícil que las directrices sean pertinentes para poblaciones tan distintas que presentan diferentes espectros de la enfermedad y cuyos recursos suelen diferir ampliamente. No es raro que las directrices ofrezcan consejos incongruentes, algo que no es de sorprender, ya que los factores locales son fundamentales para determinar el impacto y las estrategias de manejo de la infección por H. pylori. Es importante que el asesoramiento clínico se base en la mejor información disponible a nivel local, y que no se extrapolen pautas elaboradas en otras regiones, ya que pueden no aplicarse en contextos diferentes. Sin embargo, en muchas de las zonas donde H. pylori tiene mayor impacto, se carece de datos de alta calidad para establecer cuál podría ser la mejor práctica local. Esta carencia de conocimientos representa un reto importante. Mientras tanto, las decisiones deben basarse en las mejores pruebas disponibles localmente, en la extrapolación de datos de mayor calidad de otros lugares y en la opinión de los expertos.
El propósito de esta actualización de la guía de la WGO es resumir y revisar la evidencia de varias directrices nuevas que resumen las mejores prácticas, y sugerir cómo se pueden aplicar estos principios en diferentes lugares utilizando el enfoque de “cascadas”. Este enfoque reconoce las variaciones en la prevalencia y el impacto regional de la infección y las grandes diferencias en los recursos sanitarios con que se cuenta en cada lugar para encarar el problema, ya que se requieren enfoques locales pragmáticos y especialmente adaptados. La carga de la enfermedad provocada por H. pylori recae de forma desproporcionada sobre las regiones con menos recursos, que no están suficientemente representadas en las encuestas epidemiológicas y que suelen ser dejadas de lado en las directrices clínicas.
Declaración clave
Es muy difícil lograr que las directrices sean relevantes para un amplio abanico de poblaciones con diferentes espectros de la enfermedad y con recursos terapéuticos muy diferentes.
3. Historia natural, transmisión y epidemiología - aspectos globales
3.1 Historia natural de la infección
La infección por H. pylori suele persistir toda la vida, a menos que se trate con antibióticos o se erradique por sí misma cuando una infección de larga data provoca una atrofia y metaplasia generalizada de la mucosa gástrica con aclorhidria. En algunos lactantes puede producirse una infección transitoria. En adultos que han sido tratados, la reinfección es poco frecuente tanto en las regiones de mayor prevalencia como en las de menor prevalencia. La reinfección puede confundirse con la recrudescencia cuando los antibióticos no logran erradicar la infección, pero la suprimen transitoriamente, por debajo del umbral de detección analítica. Las diferentes cepas de H. pylori a nivel mundial tienen distintos niveles de virulencia. La interacción entre el hospedero y los factores ambientales puede determinar diferencias en la expresión de la enfermedad.
3.2 Transmisión de la infección
Si bien existen factores de riesgo de infección bien descritos e hipótesis plausibles, aun no se ha establecido de forma definitiva el modo preciso de transmisión. La mayoría de las infecciones parecen producirse en la primera infancia, y una minoría de casos se desarrolla en adultos. Tanto los estudios epidemiológicos como genéticos muestran fuertes evidencias a favor de una transmisión de persona a persona, sobre todo en el seno de las familias. Las madres parecen ser especialmente importantes en la transmisión a sus hijos pequeños. La vía más plausible de ingestión del microrganismo parece ser gastro-oral u oral-oral. La transmisión fecal-oral parece menos probable, al menos en los países desarrollados. La cuestión de si la transmisión se produce a través del agua, los alimentos, los animales domésticos o las moscas sigue siendo objeto de especulación.
3.3 Epidemiología
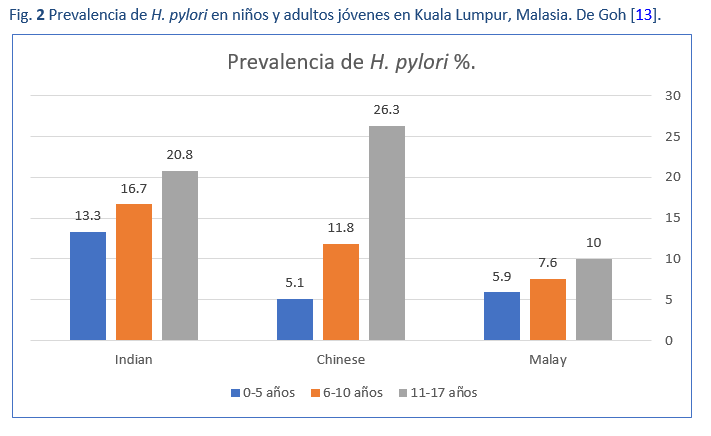
Aunque se cree que la mitad de la población mundial está infectada por H. pylori, existe una amplia variación en la prevalencia de la infección, entre países y dentro de ellos (Fig. 1). Además, la prevalencia puede variar dentro de una misma ciudad y también entre subgrupos de una población (Fig. 2) [13]. Es así que puede haber grandes variaciones en la prevalencia entre las poblaciones urbanas más ricas y las rurales.
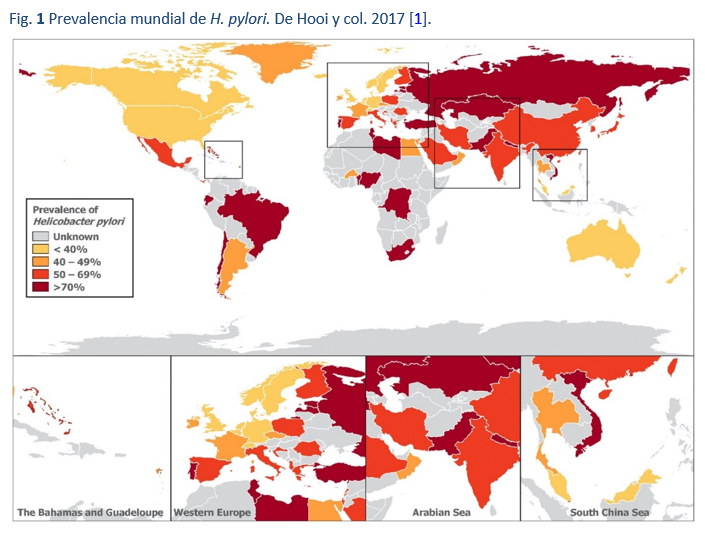
La calidad de los datos de prevalencia varía. Muchos estudios no son verdaderos estudios de prevalencia, sino auditorías de subconjuntos clínicos. Otros estudios pueden no representar un corte transversal válido de la población. Además, existe una importante variabilidad en la calidad de los informes. En algunas regiones, los métodos de diagnóstico pueden ser menos fiables, mientras que algunos países están mal representados porque se carece de información fiable. Por todas estas razones, no se puede considerar que una sola cifra resuma y represente la prevalencia de la infección en todo un país y debe aplicarse con precaución. Por ejemplo, es poco probable que un estudio de prevalencia de una ciudad en una región de un país populoso y multiétnico con una amplia variación de los niveles socioeconómicos represente la verdadera prevalencia en todo el país, y no puede reflejar subconjuntos de alto y bajo riesgo. Sin embargo, normalmente se puede caracterizar a los países y las regiones como lugares de prevalencia alta, media y baja [1].
El principal determinante de la prevalencia de la infección es el estatus socioeconómico en la infancia. Los factores socioeconómicos reflejan los niveles de higiene, saneamiento, densidad de individuos y nivel educativo.
Sistemáticamente se ha descrito una fuerte relación inversa. Es así que, como era de esperar, la prevalencia de la infección es generalmente mayor en los países en desarrollo, y la infección es casi omnipresente en algunos de los subconjuntos más carenciados de estas poblaciones. En los países más desarrollados y de baja prevalencia los migrantes provenientes de esas regiones son reconocidos como un grupo de alto riesgo.
Declaración clave
El principal determinante de la prevalencia de la infección es el estatus socioeconómico en la infancia.
La prevalencia de la infección por H. pylori aumenta con la edad. Esto se debe sobre todo al efecto de cohorte, en el que el riesgo de adquirir la infección fue mayor durante la infancia de los nacidos hace más tiempo en comparación con los nacidos más recientemente, y no por reflejar la adquisición continua en la edad adulta. El origen étnico está descrito como un factor de riesgo; lo más probable, empero, es que esté estrechamente correlacionado con el estatus socioeconómico o las prácticas compartidas que pueden aumentar el riesgo de transmisión, más que por una base genética.
Una observación sorprendente ha sido el cambio en la prevalencia de la infección a lo largo del tiempo en algunos países. Los informes sobre el rápido descenso de las tasas de infección, más marcado en los niños y los adultos jóvenes, son frecuentes en los países desarrollados y en los países que han tenido un rápido desarrollo económico que ha llevado a un aumento del nivel socioeconómico. En estos países, la prevalencia de la infección es baja actualmente.
Esta observación permite predecir un descenso gradual de la prevalencia de la úlcera péptica y del cáncer gástrico no del cardias, ya que en general la prevalencia de la úlcera péptica y del cáncer gástrico refleja la prevalencia de H. pylori en una población. De hecho, la prevalencia de la enfermedad ulcerosa y del cáncer gástrico ha disminuido durante décadas en los países desarrollados. El descenso de la expresión de la enfermedad va muchos años detrás del descenso de las tasas de infección. El descenso de la prevalencia de la infección y la enfermedad se produjo mucho antes de que se reconociera al H. pylori y se desarrollaran los tratamientos.
Como ocurre con la mayoría de las enfermedades infecciosas endémicas, la disminución de la prevalencia tiene más que ver con las mejoras en la higiene y el saneamiento de la población que con el tratamiento individual, caso por caso, ya que en la mayoría de los países, sólo una minoría de los individuos infectados llega a recibir terapia. Hay excepciones a destacar, como los países de alta prevalencia con buenos recursos, como Japón, donde el tamizaje y el tratamiento se realizan ahora sistemáticamente en la edad adulta temprana. La prevalencia de la infección parece ser estable en los países en los que los estándares no han mejorado o se han deteriorado, y es poco probable que disminuya sustancialmente antes de que se produzcan mejoras. La úlcera péptica sigue estando muy extendida en muchos de estos países. La carga del cáncer gástrico también recae de forma desproporcionada sobre estas poblaciones.
Declaración clave
Como ocurre con la mayoría de las enfermedades infecciosas endémicas, la disminución de la prevalencia tiene más que ver con las mejoras en la higiene y el saneamiento de la población que con el tratamiento individual, caso por caso, ya que en la mayoría de los países sólo una minoría de los individuos infectados llega a recibir tratamiento.
4. El impacto de la infección por H. pylori y el efecto de la erradicación
4.1 H. pylori y la úlcera péptica
El reconocimiento de que H. pylori era la causa de la mayoría de las úlceras duodenales y de aproximadamente dos tercios de las úlceras gástricas fue un avance médico fundamental, por el que se otorgó un Premio Nobel [14]. En muchos países desarrollados, donde la prevalencia de la infección es cada vez menor y donde los pacientes con úlceras se curan, la proporción de todas las úlceras pépticas debidas a H. pylori está disminuyendo. En los países menos desarrollados, donde la prevalencia de la infección sigue siendo alta y es menor el número de enfermos de úlcera que reciben tratamiento curativo, la enfermedad de úlcera péptica (UP) sigue siendo una afección muy frecuente e importante. Se calcula que la infección por H. pylori confiere un riesgo individual de úlcera péptica del 15 al 20% a lo largo de la vida. No tratada, la UP es una enfermedad crónica recidivante y remitente que causa una importante mortalidad y morbilidad a causa de dolor, hemorragias y perforaciones, además de provocar pérdidas económicas. La erradicación de H. pylori cura la mayoría de las úlceras pépticas activas y evita nuevas recaídas, con lo que se logra la curación. La erradicación de H. pylori en pacientes con antecedentes de enfermedad ulcerosa previene las recaídas posteriores.
Los AINE y la aspirina causan la mayoría de las úlceras pépticas restantes. H. pylori y los AINE actúan de forma sinérgica aumentando el riesgo de úlceras y hemorragias. Este riesgo se reduce si antes de iniciar el tratamiento crónico con AINE se erradica el H. pylori.
4.2 H. pylori y cáncer gástrico y linfoma MAL
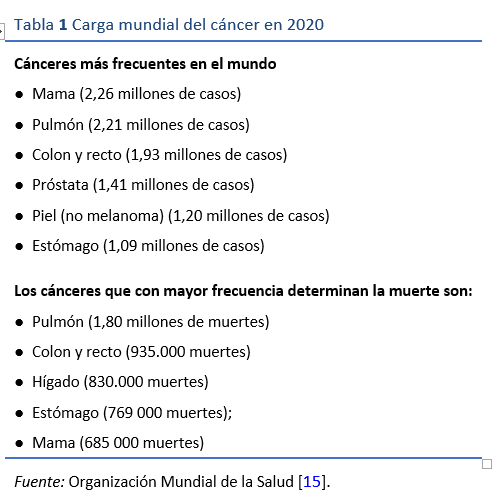
En hospederos infectados susceptibles, la gastritis crónica activa de larga data puede originar atrofia de la mucosa gástrica con metaplasia intestinal. En una minoría, estos cambios premalignos de la mucosa evolucionan hacia una displasia, luego un cáncer temprano clínicamente silencioso, y por último un cáncer gástrico avanzado. Es frecuente que al presentarse el paciente, su cáncer gástrico ya esté en una fase avanzada y sintomática y el pronóstico generalmente sea malo. Se ha estimado que H. pylori confiere un riesgo individual de cáncer gástrico a lo largo de la vida del 1,5-2,0% en individuos infectados. Pese a que el riesgo individual es relativamente bajo, dado que se estima que hay miles de millones de personas infectadas a nivel mundial, la carga global de cáncer gástrico supera el millón al año, y tiene una alta tasa de mortalidad (Tabla 1) [15]. Esta carga no se distribuye uniformemente. Asia oriental -Japón, Corea y el este de China- tiene la mayor prevalencia de la enfermedad. China es responsable del 40% de los casos mundiales de cáncer gástrico. La mayoría de los cánceres gástricos, aunque no todos, están relacionados con H. pylori. El riesgo de progresión a cáncer gástrico varía y está relacionado con factores del hospedero y del patógeno. Entre los cofactores del hospedero se incluyen el tabaquismo y la dieta. La ingesta elevada de sal, el consumo de alimentos a la vinagreta o en escabeche y las dietas bajas en antioxidantes son cofactores dietéticos. Los factores de riesgo genético en el hospedero que se asocian a un mayor riesgo incluyen la presencia de polimorfismos en los genes que determinan la expresión de la interleucina-1 (IL-1; citoquinas proinflamatorias) y receptores de reconocimiento de patógenos. El estudio genotípico de las cepas de H. pylori ha revelado diferencias en los factores de virulencia que promueven la inflamación y se asocian a un mayor riesgo de cáncer.
Se ha demostrado que la erradicación de H. pylori antes de que se produzcan cambios histológicos precancerosos adversos previene el cáncer gástrico y es la razón de ser de los programas masivos de detección y tratamiento en adultos jóvenes en países con una elevada carga de la enfermedad y con recursos suficientes para esa tarea. En las regiones con menos recursos y con una elevada carga de cáncer gástrico, esta estrategia sigue siendo una aspiración más que una posibilidad, dadas las limitaciones presupuestarias, las dificultades logísticas y otras necesidades sanitarias que compiten por los recursos.
La erradicación de H. pylori después de la aparición de atrofia de la mucosa y/o metaplasia intestinal puede reducir el riesgo de cáncer gástrico, pero no lo elimina [16]. En cualquier individuo, el riesgo residual está relacionado con la extensión y la gravedad de las alteraciones de la mucosa, así como con otros factores de riesgo del hospedero. La vigilancia endoscópica de la metaplasia intestinal puede ser apropiada en algunos contextos.
El linfoma del tejido linfoide asociado a la mucosa gástrica (MALT) es poco frecuente. La mayoría de los casos son consecuencia de una infección por H. pylori, y la erradicación de esta bacteria cuando el linfoma se encuentra en una fase de bajo grado provoca la regresión y la curación. Se han descrito ocasionales recidivas tardías tras la erradicación
Declaración clave
Se ha demostrado que la erradicación de H. pylori antes de que se produzcan cambios histológicos adversos y precancerosos previene el cáncer gástrico y es lo que justifica los programas masivos de detección y tratamiento en adultos jóvenes en países con una elevada carga de la enfermedad y con recursos suficientes para esta tarea.
4.3 Dispepsia asociada a H. pylori
La mayoría de las gastritis por H. pylori son asintomáticas, pero es frecuente que se asocien a síntomas intestinales altos en ausencia de enfermedad ulcerosa. Sin embargo, sólo un tercio o menos de los pacientes infectados con “dispepsia funcional” logra un alivio sostenido de los síntomas tras el tratamiento de erradicación. Esto se debe a que la dispepsia funcional es una condición heterogénea que puede deberse a diferentes mecanismos. H. pylori puede ser la causa en algunos pacientes con síntomas, mientras que su presencia puede ser incidental en otros. Sin embargo, la proporción de pacientes infectados que mejora tras la terapia de erradicación es mayor que la de aquellos a los que se les administra una terapia empírica de supresión de ácidos. Además, los pacientes pueden beneficiarse de una reducción del riesgo de enfermedad ulcerosa y cáncer a lo largo de su vida, especialmente si se los trata antes de la aparición de alteraciones histológicas adversas en la mucosa gástrica.
Una reciente clasificación revisada de la gastritis ha reconocido la dispepsia asociada al H. pylori como una entidad claramente definida, y se la ha incorporado a la 11ª revisión de la Clasificación Internacional de Enfermedades (CIE-11) [11]. La clasificación también subraya la importancia de la gastritis por H. pylori como lesión precursora que conduce a la úlcera péptica y al cáncer gástrico, independientemente de la presencia de síntomas.
La infección por H. pylori se ha asociado a varias afecciones más. En la mayoría de los casos no se ha demostrado que la asociación sea causal, y es inevitable que en algunos pacientes sean frecuentes la comorbilidades. Hay evidencia modesta que relaciona el H. pylori con la púrpura trombocitopénica inmunitaria, y se han hecho intentos por erradicar al H. pylori con resultados variables.
5. Diagnóstico de infección por H. pylori
5.1 ¿A quién hay que hacer estudiar y tratar?
La decisión de tratar o no el H. pylori debe ser una decisión activa que tenga en cuenta las circunstancias y los riesgos de cada paciente. Por lo tanto, la decisión de realizar una prueba de detección de H. pylori sólo se justifica si hay intención de tratar en caso de hallarlo.
Buena práctica
La decisión de estudiar la presencia de H. pylori sólo debe tomarse si hay intención terapéutica.
Las indicaciones basadas en la evidencia para las pruebas y el tratamiento de H. pylori se resumen en la Tabla 2 [4,17]. La aplicabilidad de cada indicación en diferentes regiones dependerá de la prevalencia de la infección y la enfermedad, los recursos, la coexistencia de otras necesidades que compitan por recursos y los factores individuales de cada paciente. La úlcera péptica es la principal indicación en la mayor parte del planeta. Los beneficios clínicos y sanitarios de una terapia curativa a corto plazo para una enfermedad frecuente, crónica e importante han sido ampliamente demostrados a lo largo de muchos años. En las regiones con pocos recursos, esta indicación terapéutica debería ser una prioridad.

6. Cómo estudiar la presencia de H. pylori
6.1 Pruebas de diagnóstico endoscópico
Las pruebas diagnósticas de la infección por H. pylori pueden ser invasivas (endoscópicas) o no invasivas (no endoscópicas) (Tabla 3). Las biopsias tomadas en la endoscopia suelen destinarse al análisis histológico y la prueba de la ureasa. Es menos frecuente que se cultiven las piezas de biopsia con fines diagnósticos, a menos que se disponga de pruebas de resistencia bacteriana y sea necesario estudiar la sensibilidad para respaldar las decisiones clínicas a nivel individual o para determinar las tasas de resistencia en la población. Lo más eficaz para el diagnóstico suele ser una combinación de dos modalidades de pruebas tomadas de dos localizaciones topográficas en el estómago. En la práctica, eso en general significa que se envíen las biopsias del antro y del cuerpo del estómago para histología y del antro para una prueba de ureasa. Se pueden utilizar protocolos de biopsia más estructurados cuando hay una necesidad adicional de vigilancia histológica, como en los protocolos Operative Link on Gastritis Assessment (OLGA) y Operative Link on Gastritis/Intestinal-Metaplasia Assessment (OLGIM) [18]. La histología suele ser costosa y muy dependiente del operador, y no se puede suponer que sea exacta más que en comparación con otras modalidades de pruebas anteriores.
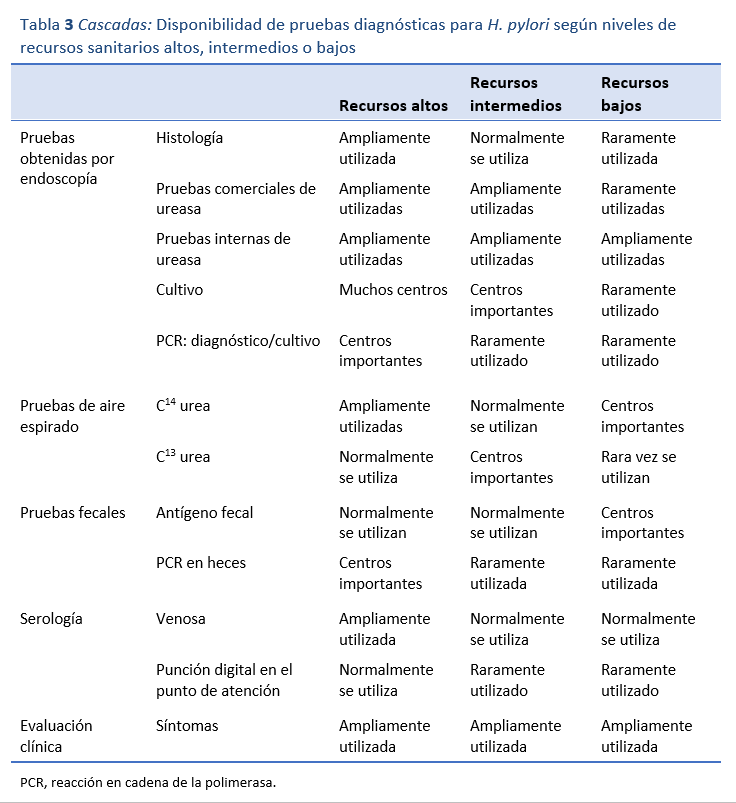
En las regiones con recursos limitados es habitual recurrir a las pruebas de ureasa. La mayoría de las pruebas de ureasa comerciales parecen tener una sensibilidad de alrededor del 95%. Aunque son mucho menos onerosas que la histología, estas pruebas igual pueden suponer una importante carga de costos en las regiones con pocos recursos, especialmente cuando es el paciente quien tiene que pagar. Una prueba comercial suele costar 5 dólares. En regiones donde el ingreso medio diario de un trabajador no cualificado puede ser de 1 a 2 dólares, ese precio tal vez no sea asequible. Afortunadamente, desde hace muchos años se dispone de pruebas genéricas de ureasa muy económicas que pueden realizarse in situ, a unos 20 centavos de dólar la unidad. Suelen ser pruebas no tamponadas que dan un resultado muy rápido y tienen una sensibilidad muy parecida a la de las pruebas comerciales [19]. Se utilizan en algunos países de África, Asia y la región del Pacífico.
El cultivo de H. pylori a partir de biopsias requiere condiciones especiales de transporte y determinados equipos de laboratorio y habilidades. Las tasas de éxito de los cultivos pueden alcanzar el 90% en los centros bien capacitados, pero suelen ser inferiores en centros menos sofisticados. El subcultivo para la realización de pruebas antimicrobianas tampoco siempre da buenos resultados en los laboratorios menos expertos, por lo que no siempre se pueden obtener resultados cuando se necesitan. En la actualidad existen pruebas comerciales de reacción en cadena de la polimerasa (PCR) en tiempo real que permiten la detección de H. pylori con altos niveles de sensibilidad y especificidad; permiten también detectar las mutaciones que causan resistencia a la claritromicina [20-22–22]. Estas pruebas no requieren condiciones preanalíticas estrictas y pueden realizarse en pocas horas. La validación y aplicación de estas pruebas rápidas y baratas de resistencia antibiótica en los puntos de atención promete ser un gran avance en el manejo de estos pacientes. La disponibilidad de estas pruebas en las regiones de alta resistencia puede ser de gran ayuda al elegir la terapia para cada paciente individual, al tiempo que facilita las encuestas de prevalencia de la población.
Buena práctica
La validación y aplicación de los kits de pruebas rápidas y baratas por PCR para diagnóstico y resistencia a los antimicrobianos promete ser un gran avance en el manejo de estos pacientes.
El diagnóstico endoscópico de la enfermedad ulcerosa duodenal en una región de alta prevalencia y escasos recursos, en un paciente que no recibe AINE, tiene una precisión del 95% para predecir la presencia de H. pylori. Si bien es deseable contar con la biopsia para confirmar la infección, la mera presencia de la úlcera duodenal tiene un valor predictivo similar al de la mayoría de las pruebas, por lo que es razonable tratar al paciente sin incurrir en más gastos (a menos que se disponga de pruebas genéricas de ureasa baratas).
6.2 Pruebas de diagnóstico no invasivas
Cuando la endoscopia no es necesaria o no está disponible, se pueden utilizar pruebas no invasivas. Las pruebas de aliento con urea (PAU) son muy útiles y tienen mayor exactitud diagnóstica que otras pruebas no invasivas para identificar el H. pylori (en pacientes sin antecedentes de gastrectomía). Resulta sorprendente que estas pruebas no se consigan fácilmente en muchos países con gran frecuencia de H. pylori y úlcera péptica. Las razones son complejas, y pueden incluir la falta de experiencia o recursos para instalar y operar laboratorios que hagan pruebas de aliento, el costo relativamente alto de los kits de pruebas comerciales, o la excesiva dependencia de la terapia empírica o la endoscopia. En muchos casos, la ansiedad válida por el cáncer gástrico es un factor importante para el uso de la endoscopia (aunque una vez que se vuelven sintomáticos, los cánceres gástricos rara vez son curables). Los costos de las PAU varían. En los países con mayores recursos, los costos se comparan muy favorablemente con los de la endoscopia, aunque en las regiones en las que la endoscopia es relativamente barata, la ventaja de los costos desaparece a menos que se disponga de PAU de bajo costo. La prueba de aliento con urea marcada con el isótopo estable C13 ha sido validada en detalle en muchos lugares, y suele preferírsela en regiones con buenos recursos. La PAU con C14 utiliza una dosis muy baja de isótopo radiactivo y suele tener un tiempo de recogida más corto, pero no ha sido validada tan extensamente. Puede ser algo menos exacta. Los costos de instalación del laboratorio para las PAU con C13 son más elevados, ya que se requiere un espectrómetro de masas, mientras que para las PAU con C14 se necesita un detector de centelleo que es menos oneroso. El costo unitario real (no el comercial) del isótopo C14 es bajo, por lo que la prueba podría realizarse a un costo muy bajo utilizando un modelo de laboratorio central “hub and spoke” al que se envíen las muestras de aliento recogidas en toda una región. Existen kits y analizadores comerciales para el punto de atención. La exactitud varía y el costo unitario de estos kits suele ser elevado.
Las pruebas de antígenos fecales son otra opción. Estas pruebas parecen ser casi tan precisas como las PAU, pero tanto los pacientes como el personal sanitario y de laboratorio suelen tener una menor preferencia por las pruebas que impliquen heces. En algunos lugares el costo es un problema. También existen pruebas rápidas fecales de PCR [21]. Si bien la aceptación de estas pruebas enfrenta los mismos obstáculos, además de requerir equipos y habilidades de laboratorio, ofrecen la posibilidad de un diagnóstico rápido con comprobación de resistencia a los antibióticos en una única prueba no invasiva.
Las pruebas serológicas de anticuerpos están disponibles en general. Aunque son útiles para relevamientos seroepidemiológicos, estas pruebas suelen carecer de la sensibilidad y especificidad necesarias para decidir qué hacer con cada paciente individual y, por lo general, carecen de una gran utilidad. Es necesario validarlas para lugares específicos, y rara vez se ha abordado el problema de los resultados falsos por reactividad cruzada. En una comunidad con una prevalencia moderada de H. pylori, la exactitud de estas pruebas puede no superar el 50%.
6.3 Pruebas para evaluar el resultado tras el tratamiento de erradicación
Dado que el éxito de la erradicación es muy variable, lo ideal es evaluar los resultados en todos los pacientes, aunque esto puede no ser factible universalmente. Debe darse prioridad a los que siguen teniendo un mayor riesgo de sufrir daños si la infección continúa, como aquellos pacientes que reciben tratamiento por una enfermedad ulcerosa complicada (hemorragia o perforación).
Se pueden realizar pruebas a partir de biopsias para determinar el resultado del tratamiento de erradicación cuando el paciente requiere una endoscopia (para evaluar la curación de la úlcera gástrica y descartar una neoplasia, o para vigilar una histología adversa, por ejemplo). De lo contrario, se prefieren las pruebas no invasivas. Las PAU y las pruebas fecales deben realizarse cuando haya transcurrido como mínimo un mes de la finalización del tratamiento de erradicación. Para reducir los falsos negativos a un mínimo, el paciente no debe tomar antibióticos ni compuestos de bismuto durante al menos un mes antes de la prueba, y debe evitarse el uso de inhibidores de la bomba de protones (IBP) durante al menos una y preferiblemente dos semanas. La serología no sirve para evaluar el resultado, ya que los niveles de anticuerpos suelen persistir años después del tratamiento. Pese a que las pruebas diagnósticas no invasivas, y en particular las pruebas del aliento han sido ampliamente validadas, todavía no se encuentran disponibles a bajo costo en muchos lugares del mundo, lo que constituye una importante necesidad clínica no cubierta.
6.4 Vías de diagnóstico
La elección de la prueba diagnóstica depende en gran medida del contexto clínico, la disponibilidad, la experiencia y el costo. Si se dispone de todas las modalidades de diagnóstico, la cuestión clave es si es preciso hacer una endoscopia para estudiar los síntomas o los signos de la enfermedad del intestino superior. En los países más desarrollados y con baja prevalencia, la evaluación de una enfermedad por reflujo gastroesofágico (ERGE), dispepsia funcional, preocupación por cáncer de esófago y cardias son frecuentes indicaciones de endoscopia, y lo habitual es aprovechar el momento para realizar una biopsia gástrica para detectar H. pylori. El H. pylori sigue siendo un problema en estas regiones, sobre todo en los subgrupos de mayor riesgo, como los pacientes de edad avanzada y los de menor nivel socioeconómico, o los inmigrantes procedentes de regiones de alta prevalencia. En estos países, la estrategia no invasiva de “prueba y tratamiento” con PAU ha sido validada en pacientes jóvenes, mostrando ser rentable, aunque su uso tal vez esté disminuyendo. En cambio, a menudo se realiza un ensayo empírico de terapia con IBP en atención primaria, y se recurre a la endoscopia si no se logra alivio de los síntomas. Aunque es popular, esta estrategia es problemática cuando los síntomas no son típicos de la ERGE, y no queda clara cuál sería la duración ideal de dicho ensayo de tratamiento. Puede llevar a que no se llegue a diagnosticar el H. pylori. Aun en los casos en los que la presentación del microorganismo sea fortuita el tratamiento en adultos jóvenes se acompaña de una reducción significativa del riesgo a largo plazo. La rentabilidad de las estrategias de tratamiento del H. pylori en los países con buenos recursos y menor prevalencia varía en función de los costos locales de la salud.
En los países con mayor prevalencia, tanto el médico como el paciente claramente suelen preferir una endoscopia rápida, por el temor al cáncer gástrico, aunque, como se ha señalado, no es seguro que esto mejore la supervivencia cuando los pacientes se presentan con síntomas. Al decidir qué hacer con cada paciente individual, hay que tener en cuenta la probabilidad de infección previa a la prueba, la edad del paciente, la naturaleza de los síntomas o signos y la prevalencia local de la enfermedad ulcerosa y el cáncer gástrico.
6.5 Terapia empírica en regiones de bajos recursos
Cuando el acceso a los medios endoscópicos o no invasivos para diagnosticar la infección por H. pylori es muy limitado, las decisiones deben tomarse empíricamente, considerando la clínica. Se puede tener una fuerte sospecha de úlcera péptica por la clínica cuando hay una historia clara de dolor abdominal alto periódico y/o antecedentes de sangrado gastrointestinal alto en el pasado o más reciente. En las regiones en las que se sabe que la prevalencia de H. pylori es alta y la úlcera péptica es frecuente, es razonable utilizar un tratamiento empírico de erradicación para hacer diagnóstico clínico presuntivo de úlcera péptica (Fig. 3). La cohorte así tratada incluirá a muchos individuos con úlcera péptica, que obtendrán un beneficio importante. También incluirá a algunos con gastritis asociada a H. pylori pero sin úlcera activa. En este grupo, la resolución de los síntomas se produce con más frecuencia que con el uso de cualquier otro tratamiento (normalmente los IBP) y, lo que es más importante, el éxito del tratamiento reduce el riesgo de padecer úlcera péptica y cáncer gástrico en el correr de la vida. Además se ha demostrado la rentabilidad del tratamiento de la úlcera péptica y la gastritis.
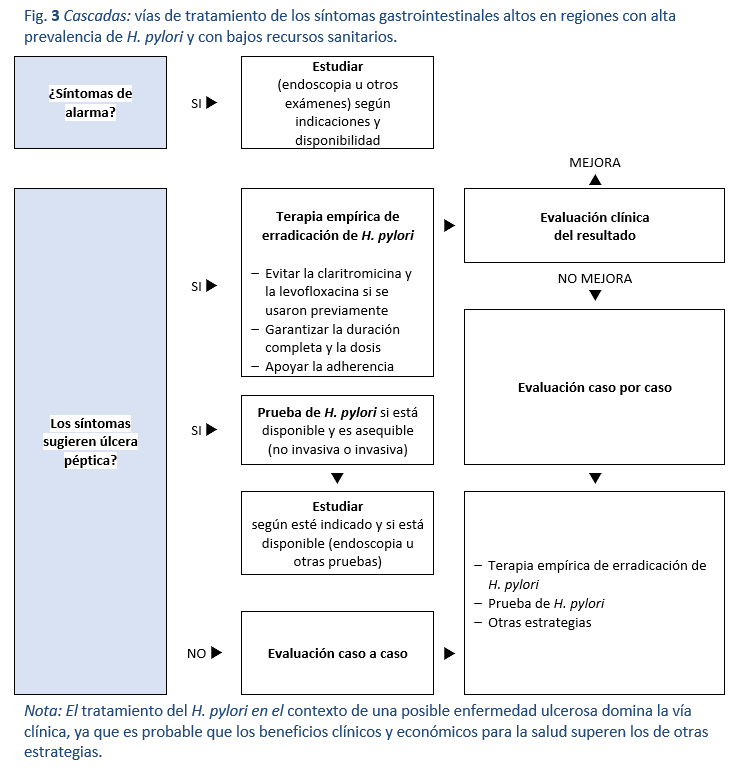
Con la terapia empírica de erradicación basada en los síntomas, habrá un subgrupo que se trate sin estar infectado y puede tener otras patologías. Este grupo no se beneficiará de una terapia de erradicación que conlleva costos y que implica el uso innecesario de antibióticos, pero la probabilidad de que se produzcan daños importantes es baja y el beneficio global para el grupo tratado justifica esta conducta. De hecho, el Grupo de consenso sobre H. pylori de Asia-Pacífico ha respaldado este enfoque en particular en regiones con alta frecuencia de H. pylori y úlcera péptica y muchas personas no tienen acceso a estudios diagnósticos, ya sea por razones económicas o geográficas. Es probable que el uso empírico de los IBP sea menos beneficioso que el tratamiento inicial. Este enfoque debería estar respaldado por programas de formación de los trabajadores de la salud, para que aprendan a reconocer los síntomas más sugestivos de enfermedad ulcerosa y apliquen esta estrategia de forma selectiva. En estas regiones con pocos recursos es más difícil justificar el tratamiento de todos los síntomas digestivos altos con este tipo de enfoque.
El uso de AINE está muy extendido, y la úlcera péptica relacionada con estos agentes es frecuente y puede coexistir con la infección por H. pylori. En un contexto empírico de sospecha de enfermedad ulcerosa, cuando se utilizan AINE (incluida la aspirina), es razonable tanto tratar el H. pylori como abordar el riesgo de los AINE dejando de utilizar estos agentes y tratando al paciente con IBP durante unas semanas tras finalizar el tratamiento de erradicación.
Buena práctica
En las regiones con pocos recursos y alta prevalencia, en las que no se dispone de pruebas diagnósticas, un cuadro que sugiera una úlcera crónica - dolor abdominal alto periódico y/o melena pasada o presente - sugiere una alta probabilidad de enfermedad ulcerosa por H. pylori y justifica un tratamiento empírico de erradicación, especialmente en pacientes sin antecedentes de uso de AINE o aspirina.
7. Tratamiento de la infección por H. pylori
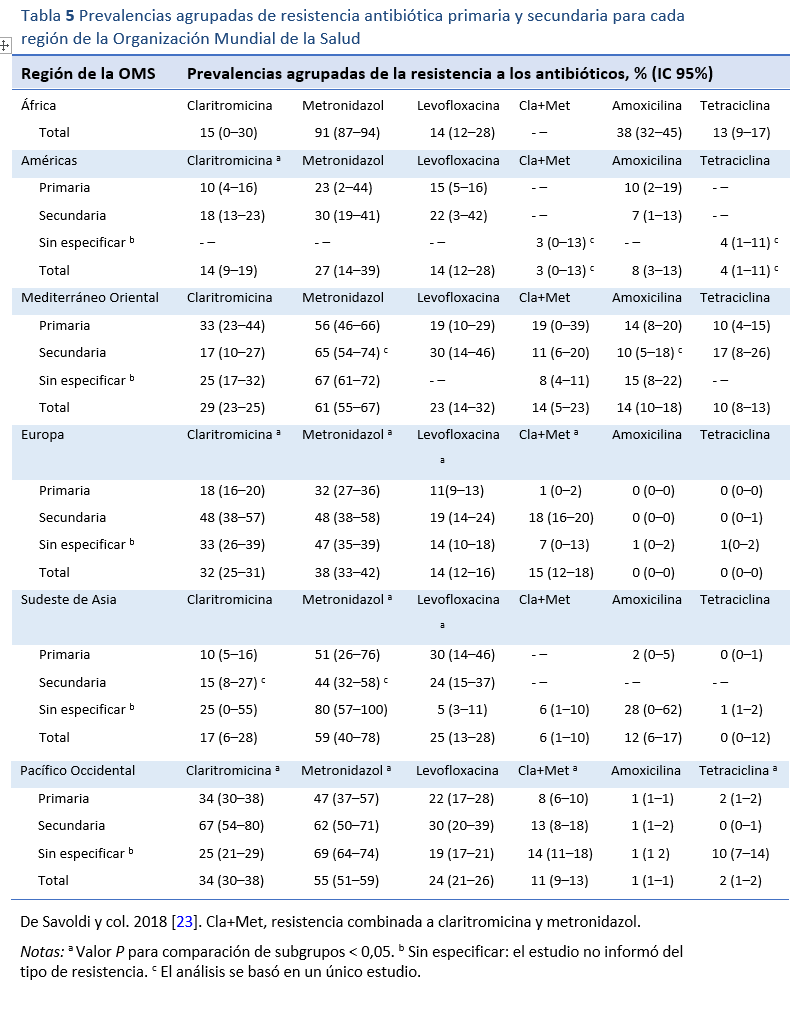
Muchos estudios han abordado las cuestiones terapéuticas, y existen numerosas directrices de expertos que recomiendan distintas opciones terapéuticas. Sin embargo, gran parte de la bibliografía y los consejos provienen de países con buenos recursos, y relativamente poco proviene de los países con pocos recursos que soportan la mayor carga de enfermedades causadas por H. pylori. Se han establecido principios para la terapia antibiótica que se aplican universalmente. Sin embargo, hay cuestiones clave que deben abordarse a nivel local para determinar cuál es la mejor práctica en ese lugar. Hay una gran variación regional de los patrones de resistencia antibiótica y, por ende, varían las tasas de erradicación [23,24] y hay otras cuestiones locales, como el costo y la disponibilidad de los fármacos, que influyen también en la elección del tratamiento. Los principios clave que guían la elección de la terapia de erradicación se describen en la Tabla 4.

8. Traducción de los principios de tratamiento en opciones terapéuticas
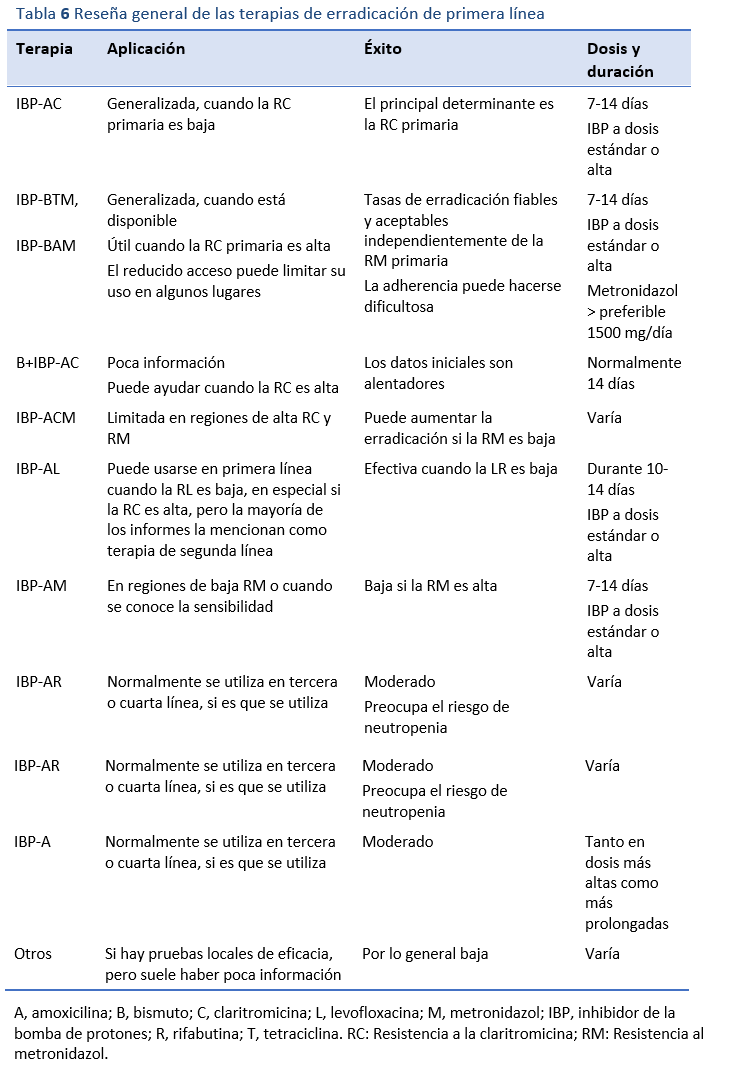
8.1 Elección del tratamiento de erradicación de primera línea
La aplicación de estos principios terapéuticos garantizará los mejores resultados posibles. En las regiones con buenos recursos, el tratamiento puede basarse en ensayos de alta calidad y en datos de auditorías y cultivos; en las regiones con pocos recursos, la confianza en el conocimiento del uso comunitario o personal de los antibióticos y cualquier auditoría local de los resultados influirá en el uso de las terapias recomendadas en las directrices de otros lugares [4-12].
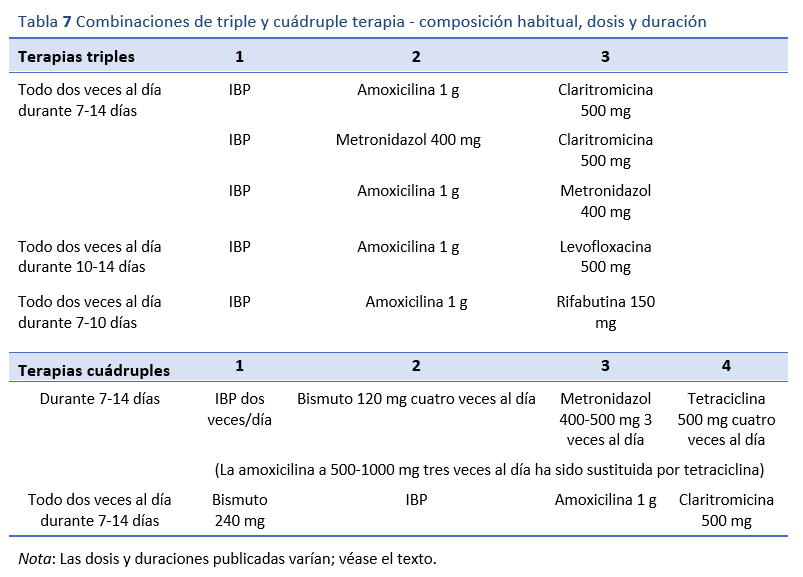
8.1.1 Triple terapia con IBP, amoxicilina y claritromicina
En muchas partes del mundo la terapia triple, que comprende un inhibidor de la bomba de protones (IBP) con amoxicilina y claritromicina (IBP-AC), sigue siendo el tratamiento de primera línea más utilizado. Esta combinación fue la primera terapia ampliamente recomendada y sustituyó a las terapias triples menos eficaces. Ha sido muy bien evaluada a lo largo de los años. El principal determinante del éxito de la erradicación con esta combinación es la resistencia a la claritromicina (RC) antes del tratamiento. La prevalencia de la resistencia a los antibióticos, en particular la RC, varía mucho en todo el mundo (Tabla 5). En los lugares en los que la claritromicina se ha utilizado y se utiliza habitualmente como monoterapia para otras infecciones, el nivel de RC suele ser elevado y va en aumento. Hay quienes opinan que esta terapia debería abandonarse en las zonas en las que se sabe que las tasas de RC primaria son del 15-20% o superiores, debido al impacto que esto tiene en las tasas de erradicación. A menudo se cita una tasa de erradicación mínima algo arbitraria del 80% por intención de tratar como punto de referencia para una terapia aceptable. Esta es una tasa de erradicación frecuente para los IBP-AC en estudios del mundo real en áreas donde las tasas de RC son moderadas o bajas (es decir, por debajo del 15-20%). En países en los que la prevalencia de la RC es más alta los resultados de erradicación pueden ser inaceptablemente menores.
Declaración clave
El principal determinante del éxito de la erradicación con IBP-AC es la resistencia a la claritromicina antes del tratamiento.
La duración óptima de la terapia es objeto de controversia. Los recientes llamamientos a favor de una terapia universal de 14 días con IBP-AC suelen proceder de regiones con mayor RC. Los estudios iniciales eran en su mayoría de 7 días, aunque esa duración puede haberse visto influida por el diseño de los ensayos de registro. Los defensores de una terapia más prolongada señalan las tasas de erradicación algo más altas descritas en las revisiones sistemáticas. Sin embargo, hay otras consideraciones que influyen en la duración de la terapia, especialmente en los países con pocos recursos. Añadir una segunda semana de terapia puede aumentar las tasas de erradicación, normalmente en un 10%. Esto significa que el número de pacientes que hay que tratar con una semana más de terapia para conseguir el éxito del tratamiento en un paciente más es de 10. El precio de esta mayor tasa de erradicación, si se consigue, implica duplicar el costo del tratamiento, lo que supone un problema importante en las regiones con pocos recursos. (Hay que tener en cuenta que el costo de una semana de terapia triple en regiones con muy pocos recursos puede equivaler a los ingresos semanales de los individuos de ingresos más bajos.) Cuando se prolonga el uso de antibióticos aumentan considerablemente tanto el riesgo de efectos adversos como la probabilidad de incumplimiento. Una alternativa es hacer una terapia más corta, lo que probablemente mejore el cumplimiento y reduzca los efectos adversos y los costos, entendiendo que un 10% más de pacientes pueden necesitar una terapia de rescate de segunda línea. El uso general de antibióticos será mucho menor con la segunda estrategia, siempre que las tasas de erradicación de primera línea sean al menos moderadamente altas. La terapia más larga suele recomendarse en algunos países con buenos recursos, pero en las regiones con pocos recursos es necesario modelar más los cursos más breves. También hay que tener en cuenta que en varios países se han notificado tasas de erradicación aceptables con una terapia consistente en IBP-AC durante una semana, y no se ha estudiado hasta qué punto mejorarían los resultados al prolongar el ciclo. En la mayoría de los lugares aún no se ha determinado cuáles serían las dosis óptimas del IBP (dosis estándar o alta) y de claritromicina (250 mg o 500 mg dos veces al día). En las regiones con alta RC no se logran tasas de erradicación aceptables ni con una ni con dos semanas de esta terapia. En esos lugares, la elección de la terapia de primera línea varía.
Se ha venido apreciando el papel y el valor de los bloqueadores de ácido competitivos con el potasio (BAC-P), como el vonoprazan, en lugar de IBP en las terapias de erradicación. Estos fármacos no se ven afectados por los polimorfismos del
CYP2C19 y provocan una inhibición más uniforme y potente de la secreción de ácido gástrico [
25].
8.1.2 Terapias cuádruples a base de bismuto
La otra opción importante para el tratamiento de primera línea, especialmente en regiones con una elevada RC primaria, sigue siendo la terapia cuádruple basada en bismuto. El régimen mejor estudiado incluye un IBP, bismuto, tetraciclina y metronidazol (IBP-BTM). Este tratamiento ha resistido la prueba del tiempo, ya que logra tasas de erradicación fiables y aceptables independientemente de la resistencia primaria al metronidazol (RM), ya que aparentemente la adición de un IBP a BTM ayuda a vencer la RM. Se han conseguido buenos resultados con la terapia de 7 días, aunque hay partidarios de tratamientos más largos (10-14 días). Los principales inconvenientes de esta terapia son la incomodidad del régimen de dosificación (ya que suele administrarse cuatro veces al día) y los efectos adversos, frecuentes pero generalmente leves, que pueden ir en desmedro de la adherencia. En algunos lugar las dificultades para conseguir bismuto y tetraciclina pueden limitar el uso de este tratamiento. Sin embargo, cuando estos medicamentos no están disponibles o no están registrados, suele ser posible importar medicamentos genéricos a bajo costo, con el permiso de las autoridades pertinentes.
Existe una terapia cuádruple que sustituye la tetraciclina por amoxicilina (IBP-BAM) descrita hace bastante tiempo; si bien es menos utilizada, puede lograr resultados aceptables.
Más recientemente, se ha descrito la conversión de la terapia triple IBP-AC estándar a una terapia cuádruple añadiendo bismuto (B+IBP-AC), con resultados favorables en algunos lugares [26]. Todavía no se ha determinado plenamente qué valor tiene esto para superar la RC, pero vale la pena evaluarlo en detalle.
8.1.3 Terapias cuádruples sin bismuto
Hay quienes propugnan por las terapias cuádruples sin bismuto, lo que suele implicar la adición de metronidazol a la terapia triple IBP-AC (IBP-ACM). Este esquema puede aumentar las tasas de erradicación si las tasas de RM son bajas o moderadas, pero es poco probable que sirva demasiado en muchas regiones del mundo que tienen resistencias primarias altas al metronidazol (RM) y/o a la claritromicina (RC). Además, es frecuente que los pacientes en los que fracasa el tratamiento presenten una doble resistencia. Este tipo de terapia concomitante se ha estudiado en países con buenos recursos, pero rara vez en países donde los recursos son escasos. Los regímenes secuenciales o híbridos están menos estudiados; no parecen mejorar la erradicación; su administración es incómoda y plantean problemas particulares de adherencia, por lo que no se recomiendan.
Cuando se conoce la sensibilidad al metronidazol de un paciente porque se le han realizado pruebas, puede recurrirse al esquema de IBP-AM como tratamiento de primera línea con resultados razonables. También es adecuado en poblaciones en las que se sabe que la RM es baja.
8.1.4 Terapia triple con levofloxacina
La triple terapia con levofloxacina (IBP, amoxicilina y levofloxacina: IBP-AL durante 10-14 días) se ha utilizado como terapia de primera línea cuando se sabe o se presume que la resistencia a la levofloxacina (RL) es baja, pero la combinación no se ha estudiado ampliamente en esas condiciones, y la mayoría de los informes la mencionan como terapia de segunda línea. Dados los informes sobre las altas tasas de resistencia a la levofloxacina en algunos países la utilidad de esta terapia quedará limitada en esos lugares. El tratamiento es generalmente bien tolerado. Recientemente se ha manifestado la preocupación por los riesgos del uso de fluoroquinolonas. En el caso de la levofloxacina, la inquietud tiene que ver con el raro riesgo de tendinitis o miositis. La prevalencia exacta de este efecto adverso no está bien documentada, pero parece ser más común en los ancianos y en quienes presentan artritis inflamatoria o deterioro renal, por lo que es mejor evitar su uso en estos subgrupos de alto riesgo si hay otras alternativas. Una dosis más alta de levofloxacina y posiblemente IBP a altas dosis puede lograr un mayor éxito de erradicación. También se ha utilizado la moxifloxacina, una quinolona emparentada, pero está menos estudiada y tiene un espectro de actividad más amplio, por lo que generalmente se prefiere la levofloxacina.
Existen otros tratamientos que, aunque menos estudiados, han sido recomendados en diversas revisiones. La furazolidona, por ejemplo, se ha utilizado en lugares con altas RC y RL, pero hay poca información de buena calidad que avale su uso en comparación con las terapias ya establecidas, y no se ha definido aún su papel preciso.
Cuando se dispone del dato de resistencia a los antimicrobianos, sea por cultivo o por prueba rápida de PCR, se puede adaptar el tratamiento a cada paciente. Es probable que eso cobre mayor importancia en las regiones con mayor resistencia primaria, ya que permitiría evitar la claritromicina en primera línea. La validación y aceptación de las pruebas de PCR en heces permitiría extender este beneficio a la atención primaria y en circunstancias en las que la endoscopia no es necesaria o accesible.
Las tablas 6 y 7 ofrecen una visión general y un resumen de los regímenes de tratamiento de primera línea y su composición.
8.2 Elección de las segundas terapias de erradicación y subsiguientes
Las terapias de segunda línea o de rescate tras el fracaso de la erradicación de primera línea han sido bien estudiadas en algunos lugares, pero hay una falta total de datos para muchas regiones con pocos recursos [4-12–12].
8.2.1 Terapia cuádruple a base de bismuto y terapia triple con levofloxacina
Las terapias de segunda línea más estudiadas y utilizadas incluyen la terapia cuádruple estándar a base de bismuto durante 7-14 días y la terapia triple con levofloxacina durante 10-14 días, como se ha descrito anteriormente. Se ha demostrado que ambas logran tasas de erradicación superiores al 80%. La elección entre ambas depende de si se conocen las tasas locales de resistencia primaria a la levofloxacina, la disponibilidad, la experiencia, la adherencia y el costo. A menudo se recomienda una terapia más prolongada (a saber, 14 días), pero faltan datos sobre los resultados locales, los costos y la adherencia. Cuando estos tratamientos fallan, la otra terapia suele ser la tercera opción. En los centros con experiencia, las tasas de erradicación total con terapias elegidas criteriosamente tras el fracaso de la primera línea deberían acercarse al 98% después de hasta tres tratamientos.
8.2.2 Otras terapias de rescate
Otras terapias de rescate que se han utilizado incluyen una triple terapia basada en la rifabutina (IBP-AR). En general, es menos eficaz y el riesgo de una neutropenia importante puede ser de hasta el 1%, lo que tiende a limitar su uso. Suele evitarse en regiones con alta prevalencia de tuberculosis. Se ha utilizado con cierto éxito la terapia doble de IBP con amoxicilina (IBP-A) en dosis altas. Las terapias cuádruples sin bismuto suelen ser ineficaces como terapias de rescate, debido a la RC y RM secundarias. Cuando luego de los estudios se conoce la sensibilidad al metronidazol, puede usarse el esquema IBP-AM como tratamiento de segunda línea con resultados razonables, pero generalmente no se utiliza como terapia de segunda línea de forma empírica. La furazolidona se ha utilizado y se recomienda como componente del tratamiento en algunas regiones. Hay pocos estudios de alta calidad sobre la erradicación que incluyan este fármaco, y los ensayos aleatorizados son muy escasos. Debido a las preocupaciones por su seguridad y su uso, no está disponible en Estados Unidos y la Unión Europea.
Cuando fracase el tratamiento pese a haberse seguido las vías de tratamiento apropiadas, deben evitarse las terapias ad hoc por capricho del profesional tratante, y debe aceptarse que hay infección en curso a menos que se disponga de conocimientos de subespecialista o en instancias de un ensayo clínico. En algunos pacientes - como los que padecen una enfermedad ulcerosa recidivante- el fracaso de la erradicación puede requerir tratamiento antisecretor de mantenimiento.
8.3 Opciones de tratamiento para pacientes con alergia a la penicilina
Para los pacientes con alergia a la penicilina, el metronidazol puede sustituir a la amoxicilina y combinarse con un IBP y claritromicina (IBP-MC). Sin embargo, la RM primaria reduce su eficacia. La terapia cuádruple con bismuto es una muy buena alternativa (IBP-BTM). Si ambas terapias fracasan, las opciones que quedan son limitadas. En los pacientes que tienen antecedentes lejanos, inciertos o improbables de alergia a la penicilina y cuando hay recursos disponibles, se puede hacer una evaluación formal de la alergia a la penicilina tipo 1. Consiste en medir los anticuerpos anti penicilina, seguido de una prueba de punción cutánea y, si es negativa, una provocación supervisada en la que se administra el fármaco por boca. Al realizar esta provocación en pacientes de bajo riesgo, se ha demostrado que hasta el 80% de estos pacientes no son en realidad alérgicos a la penicilina, y pueden recibir terapias que contengan amoxicilina si es necesario (habitualmente IBP-AL o IBP-AC si no se utilizó claritromicina inicialmente) sin que corran peligro. Se ha demostrado que esta estrategia permite la erradicación en la mayoría de los pacientes. Cuando por el contrario, los antecedentes de una reacción de tipo 1 son claros, se parte de la base que el paciente tiene alergia y no está indicado hacer las pruebas.
8.4 Vías de tratamiento
En resumen, en las regiones bien provistas de recursos en las que se conocen las tasas locales de RC y RM (y a veces de RL), la elección de tratamiento basada en la evidencia en las regiones con menor RC suele ser IBP-AC como primera línea, con terapias IBP-BTM o IBP-AL como segunda y tercera línea, en cualquier orden. En regiones con niveles más altos de RC, se puede utilizar IBP-BTM. B+IBP-AC o IBP-AL pueden ser otras terapias alternativas de primera línea. Las opciones de segunda línea dependen de lo que se haya utilizado primero: se puede utilizar IBP-BTM o IBP-AL si no se los ha utilizado previamente.
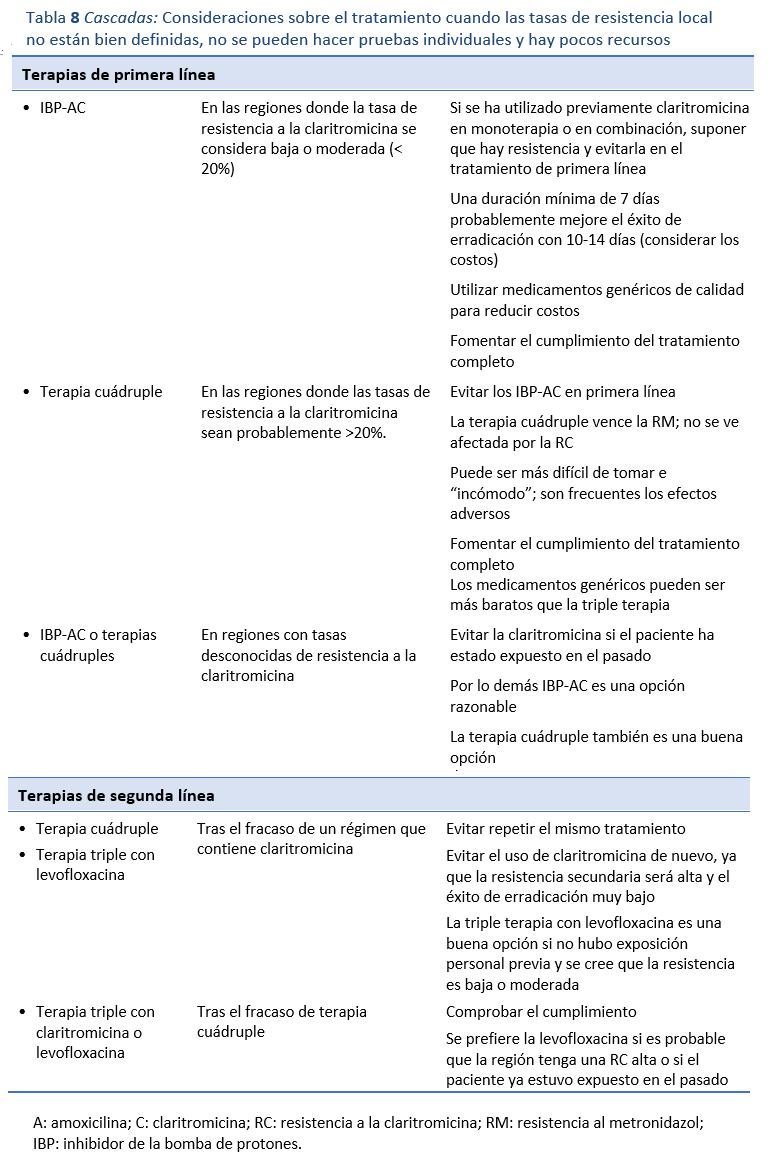
En las regiones con pocos recursos en las que no se conocen la RC y la RM comunitarias o se sabe que son elevadas, la elección de la terapia se basa en auditorías empíricas de los resultados, en los antecedentes personales de la exposición a antibióticos como monoterapia de un paciente individual, en los niveles conocidos de uso comunitario de dichos medicamentos, en la disponibilidad y en el costo (Tabla 8). La combinación de IBP-AC sigue siendo ampliamente elegida, y las combinaciones de IBP-BTM o IBP-AL, o incluso las terapias cuádruples sin bismuto, son utilizadas como terapias alternativas de primera línea o de rescate. Sin embargo, cuando se sabe que la terapia de primera línea con claritromicina arroja malos resultados, se puede optar por una de las otras terapias descritas. Es importante obtener información sobre las tasas de resistencia a la levofloxacina, ya que la RL parece ser común en muchas regiones, y la calidad de algunos datos publicados es incierta. Por lo tanto, es probable que la terapia cuádruple con IBP-BTM sea una buena elección al inicio e incluso después, ya que evita el problema de los malos resultados debidos a la resistencia. Sin embargo, su uso está a veces limitado por la disponibilidad, el cumplimiento y los efectos adversos. Sea cual sea la vía terapéutica elegida, es fundamental no repetir el mismo tratamiento, ya que la estrategia tiene muy bajo valor si fracasó en primera línea, debido a la resistencia secundaria que pudo haber generado. La tasa de éxito de la erradicación con IBP-AC, por ejemplo, puede ser del 80% o más cuando se usa en primera línea, pero tan solo 8% cuando el tratamiento se repite después de fracaso de la primera línea. En su mayor parte, eso es atribuible a la RC secundaria. Por desgracia, esta práctica sigue siendo muy extendida en algunos lugares, pero debería desaconsejarse. Por último, el acceso de los pacientes a medicamentos genéricos baratos y la educación médica siguen planteando dificultades importantes en muchas regiones.
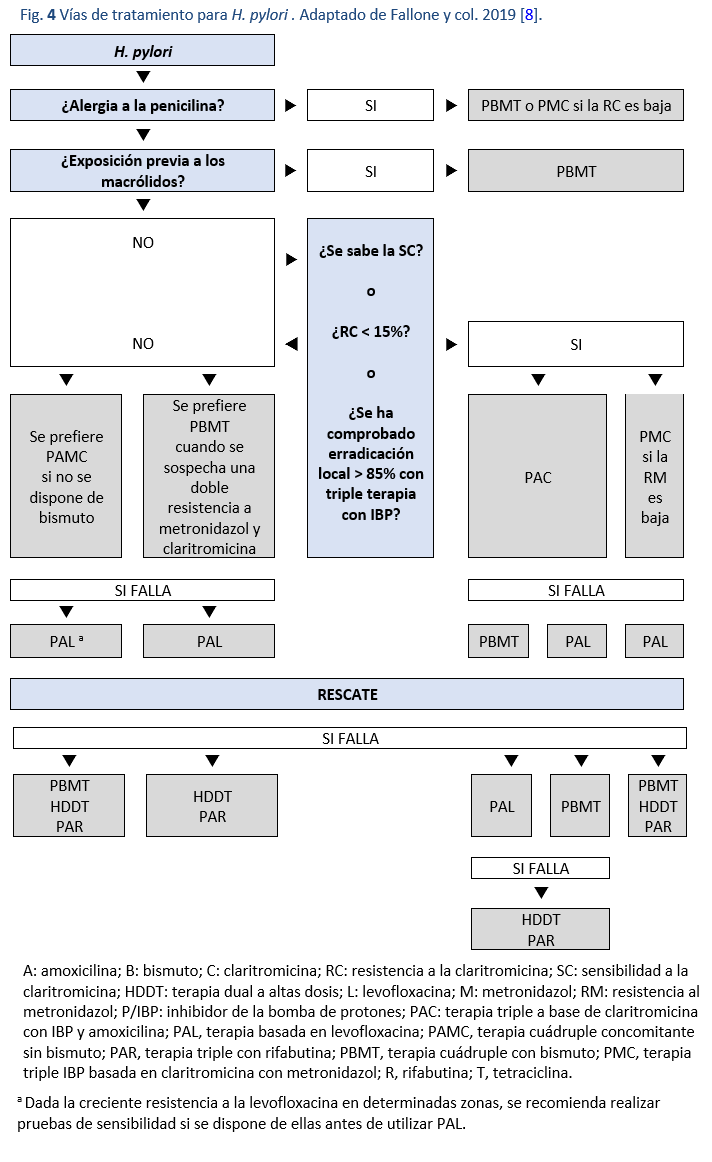
En la Fig. 4 se describe una vía adecuada para elegir la terapia.
8.5 El papel de los cultivos
El estudio de los patrones de resistencia de H. pylori permite definir la prevalencia en la población, y los cambios en la prevalencia guiarán las opciones de tratamiento. En algunos países con buenos recursos se puede adaptar el tratamiento conforme la sensibilidad antibiótica de la biopsia endoscópica del individuo antes del tratamiento. Sin embargo, esto no es la norma en la práctica clínica y, de todas formas, en los laboratorios menos expertos el cultivo y subcultivo para las pruebas de resistencia pueden fallar. Además, gran parte del tratamiento tiene lugar en el ámbito de atención primaria, donde se trabaja con estudios y tratamientos no invasivos. Tras el fracaso del tratamiento, es poco probable que las pruebas de sensibilidad a los antibióticos de los cultivos de biopsias incidan demasiado en las decisiones clínicas. Si se ha utilizado claritromicina y ha fracasado, la RC secundaria es tan frecuente que no sirve de nada hacer estudios para detectarla, y debe elegirse un tratamiento diferente. A veces es útil evaluar la RM si existe la opción de utilizar IBP-AM, pero no influye en la elección del IBP-BTM, ya que esta terapia no se ve afectada por la RM. La levofloxacina se utiliza empíricamente en la mayoría de las regiones en las que se sabe que la prevalencia de la RL es baja. Además, la sensibilidad in vitro de H. pylori a otros antibióticos no implica el éxito terapéutico, y no deberían diseñarse regímenes ad hoc de este modo.
Si se generaliza la disponibilidad de técnicas moleculares (PCR) baratas de biopsias (o materias fecales) en el punto de atención para una evaluación rápida de la resistencia, estas técnicas podrían tener un impacto importante en la selección del tratamiento y cambiar la práctica. Es posible que estas pruebas puedan sustituir a las pruebas de ureasa, confirmando la presencia de la infección y brindando información rápida sobre la resistencia a los antimicrobianos para dirigir un tratamiento individualizado, a un costo sólo un poco más alto que el de las actuales pruebas de ureasa comerciales. Los exámenes fecales permitirían adaptar el tratamiento según la sensibilidad antimicrobiana de cada paciente en atención primaria, sin necesidad de endoscopia.
8.6 Adherencia al tratamiento
Sea cual sea la terapia que se indique, hay que hacer todo lo posible por maximizar el cumplimiento. Esto significa que el profesional tratante debe dedicar tiempo para explicarle al paciente la importancia de respetar las indicaciones al pie de la letra y no interrumpir el tratamiento. Esto es especialmente importante en las regiones en las que la normativa que regula el uso de los antibióticos puede ser poco estricta o directamente ni se aplica, y en las que la gente puede conseguir antibióticos sin receta en las farmacias. Los pacientes pueden comprar fármacos en pequeñas cantidades para uno o dos días, con el riesgo de dejar de tomarlos si los síntomas no se alivian de inmediato o ante la aparición de efectos adversos. Evidentemente, se debe prescribir y dispensar todo el ciclo de la terapia de entrada. Hay que explicarle al paciente que pueden aparecer efectos adversos molestos -como una alteración transitoria del gusto, que es frecuente con la claritromicina y el metronidazol- para que su aparición no los motive a interrumpir el tratamiento. Se ha comprobado la utilidad de la estrategia de entregar material impreso de apoyo e información sobre la dosis. Como se sabe que fumar es un factor predictivo adverso para el resultado, dejar de fumar antes y durante la terapia podría mejorar los resultados, aunque esto no ha sido bien estudiado. Dejar de fumar también ayuda a la curación de las úlceras. Se ha afirmado que los probióticos ayudan a reducir los efectos adversos (y que posiblemente mejoren los resultados), pero se necesitan más y mejores pruebas para sustanciarlo.
Buena práctica
Siempre se debe advertir a los pacientes que el éxito de la erradicación depende del cumplimiento del tratamiento. Hay que dedicar tiempo a aconsejar al paciente, explicándole cómo respetar las indicaciones que incluyen muchos medicamentos y avisarle que es posible que presente efectos secundarios adversos. Hay que insistir en la necesidad de finalizar el tratamiento. La información escrita o pictórica también puede ayudar al cumplimiento.
8.7 Después del tratamiento
Sería ideal evaluar los resultados en todos los pacientes tratados, aunque en la práctica esto no se puede hacer en muchos lugares. En los casos en los que se realizó inicialmente una endoscopia y se identificó atrofia gástrica y/o metaplasia intestinal, es necesario decidir qué hacer con respecto a la vigilancia endoscópica de la mucosa [27]. Esto puede ser bueno para los pacientes individuales, pero aún no se ha demostrado claramente que reduzca globalmente la mortalidad por cáncer gástrico. Cuando se encuentra una displasia focal de alto grado en la mucosa gástrica, las áreas pueden ser extirpadas por vía endoscópica, pero una neoplasia más avanzada requiere cirugía. La displasia puede detectarse utilizando imágenes mejoradas, o mediante el mapeo de muestras de biopsia sin lesiones discretas visibles endoscópicamente. Estos pacientes requieren una reevaluación endoscópica, preferiblemente con endoscopia de imagen mejorada y con aumento, en un plazo de 6 meses para la displasia de alto grado y de 12 meses para la displasia de bajo grado.
Como la atrofia y la metaplasia intestinal son frecuentes, la vigilancia endoscópica consumirá considerables recursos de endoscopia y tendrá un costo de oportunidad frente a otras necesidades de atención sanitaria. Es por eso que generalmente sólo se ofrece vigilancia a los individuos de mayor riesgo. El alto riesgo suele implicar la presencia de alteraciones más extensas de la mucosa gástrica (que afectan al antro y al cuerpo del estómago) y/o antecedentes familiares de cáncer gástrico. La estrategia ideal está aún por determinarse. La detección y caracterización endoscópica exacta de las alteraciones de la mucosa requieren una formación específica y endoscopios modernos, así como patólogos cualificados.
9. Perspectivas regionales para una terapia de erradicación basada en información y recursos locales
9.1 Australia
En Australia se han notificado tasas bajas de resistencia a la claritromicina (6-8%) y tasas altas de resistencia al metronidazol (45-50%). Los datos sobre la levofloxacina son escasos, pero la resistencia primaria parece ser muy baja, con la posible excepción de las tasas que presentan los inmigrantes procedentes de regiones de alta resistencia. En consecuencia, la terapia triple estándar con IBP, amoxicilina y claritromicina sigue siendo la terapia de primera línea recomendada, a menos y hasta que surjan pruebas de resistencia creciente a la claritromicina. Las tasas de erradicación a los 7 días comunicadas son del 80-87%. El tratamiento de catorce días no se ha estudiado formalmente. Las terapias de rescate incluyen la triple terapia con levofloxacina durante 10 días (tasa de erradicación del 80-90%) y la terapia cuádruple a dosis estándar (IBP, bismuto, tetraciclina y metronidazol) durante 7-14 días, con resultados similares. La levofloxacina, la tetraciclina y el bismuto no están registrados a nivel local, por lo que no suelen utilizarse en el tratamiento de primera línea. Estos fármacos deben obtenerse del exterior mediante un plan de acceso especial, o a través de farmacias que elaboran fórmulas magistrales, cuando se necesitan para tratamientos de rescate. La triple terapia con rifabutina se ha utilizado con menos frecuencia (76% de erradicación). No se han estudiado terapias concomitantes a nivel local.
9.2 Región del Pacífico
Actualmente se carece de datos sobre la resistencia local y existen pocos datos sistemáticos para evaluar el resultado de la terapia. Por lo tanto, la elección de la terapia suele extrapolarse de las directrices internacionales y estar determinada por la disponibilidad de medicamentos. Es frecuente elegir la triple terapia con claritromicina, con IBP y amoxicilina o metronidazol, pese a que existe la sospecha clínica de que habría una alta RM que afectaría a la eficacia de este último. El costo, la disponibilidad, la experiencia local y el cumplimiento de la terapia son obstáculos para un tratamiento eficaz. No existen datos auditados sobre la terapia de rescate. Se desaconsejan las terapias ad hoc y la repetición del tratamiento con claritromicina tras el fracaso de la primera línea.
9.3 Sudeste Asiático
Existen pruebas fehacientes de que la resistencia a la amoxicilina y a la tetraciclina es baja y estable (< 5%), pero la RM suele ser alta (30-100%). La RC ha ido en aumento, pero varía significativamente entre los países del sudeste asiático (entre el 2% y el 43%). Para la mayoría de los regímenes, debe utilizarse una duración de 14 días, a menos que existan pruebas locales que demuestren tasas de erradicación fiables con un tratamiento más corto. Lo ideal es que los regímenes de primera línea se consideren en función de las tasas locales de resistencia a los antibióticos, debido a la amplia gama de resistencia en los distintos países. Se han informado tasas uniformes superiores al 90% para IBP-BTM. Los regímenes de segunda línea deben contener antibióticos que no se hayan utilizado anteriormente, o aquellos contra los que es poco probable que se desarrolle resistencia, como la amoxicilina o la tetraciclina. Debe considerarse el uso de IBP-BTM si aún no se ha utilizado. La rifabutina no debe considerarse en regiones con una alta prevalencia de Mycobacterium tuberculosis. Si el tratamiento de erradicación fracasa tras un segundo intento, se debe considerar la realización de pruebas de sensibilidad a los antibióticos.
9.4 Eurasia
Según un estudio piloto realizado en Armenia, la prevalencia de la seropositividad a H. pylori entre los adultos sanos en ese país es del 41,5%, y aumenta con la edad (13,6% entre los individuos de 18 a 25 años y 83,3% en los mayores de 65 años). La tasa de resistencia a la claritromicina en 2018 fue tan solo del 3,6%, y a las fluoroquinolonas 12,8%. Sin embargo, se justifica realizar nuevos estudios, especialmente durante la pandemia de COVID-19, ya que se ha producido un aumento sin precedentes en el número de prescripciones de macrólidos y fluoroquinolonas para infecciones respiratorias por parte de los prestadores de atención primaria en el país. La tetraciclina sólo está disponible en comprimidos de 100 mg, lo que hace muy inconveniente el régimen cuádruple convencional. Las recomendaciones locales adaptadas de las directrices de Maastricht proponen una terapia triple de claritromicina de 14 días como tratamiento de primera línea y una terapia cuádruple de bismuto modificada (IBP, bismuto, amoxicilina y metronidazol) como terapia alternativa de primera línea. Las opciones de segunda línea incluyen el tratamiento triple o cuádruple con levofloxacina. No se ha estudiado la eficacia de ninguno de los regímenes de erradicación a nivel local.
9.5 Europa occidental
La RC es muy importante para la selección del tratamiento de primera línea; sus cifras varían entre los diferentes países europeos y dentro de ellos. Por lo tanto, el seguimiento de la resistencia a los antibióticos sigue siendo esencial a nivel de la población. Los datos de un registro europeo reciente que incluye más de 30.000 pacientes de 27 países [28],] indican tasas de resistencia antes del tratamiento de 23% para claritromicina, 32% para metronidazol y 13% de resistencia a ambos. Existe una dicotomía, con una menor RC en el centro y el norte de Europa; en Alemania, la RC primaria sigue estando por debajo del nivel de corte del 15%. La triple terapia con amoxicilina y claritromicina durante 14 días sigue siendo eficaz en estas condiciones y se utiliza habitualmente como tratamiento de primera línea. En las zonas donde la RC primaria es >15%, se recomienda el tratamiento cuádruple con bismuto durante 10 días (o 14 días si los componentes de este régimen se administran individualmente) como tratamiento de primera línea. En la mayoría de los países no resulta popular la terapia concomitante que incluye tres antibióticos en lugar de los dos utilizados en el tratamiento cuádruple a base de bismuto. En las terapias triples con IBP el uso del metronidazol se ha abandonado en su mayor parte y ahora se reserva para casos individuales (por ejemplo, en casos de alergia a la amoxicilina o de sensibilidad demostrada al metronidazol).
La creciente resistencia a la levofloxacina ha excluido a este antibiótico como componente de los regímenes de primera línea. Su uso es cada vez más preocupante, incluso en segunda línea. La rifabutina es eficaz en el tratamiento de tercera línea y se recomienda como componente de un régimen de rescate tras fracasos terapéuticos repetidos.
Las recomendaciones europeas destacan la importancia de las pruebas (C13-PAU) para evaluar la respuesta individual al tratamiento. Se promueve la realización de pruebas de resistencia a los antibióticos de uso común tras los fracasos del tratamiento.
9.6 Europa meridional
El aumento de la resistencia a los antibióticos es el principal problema. Antes de iniciar el tratamiento de primera línea con claritromicina debería confirmarse la sensibilidad antibiótica, pero actualmente no es factible para la mayoría de los pacientes. Por tanto, la elección del tratamiento se basa en la prevalencia local de la RC. Sin embargo, se carece de esta información en la mayoría de las regiones de Italia; se ha informado una alta prevalencia (30%) en algunas regiones del centro y del sur. Se recomienda una terapia cuádruple con bismuto de 10 o 14 días o una terapia cuádruple concomitante sin bismuto como tratamiento de primera línea cuando la RC es >15% o se desconoce. La eficacia de estos dos regímenes no se ve afectada por la RC o la RM, y la terapia cuádruple a base de bismuto funciona bien cuando hay resistencia dual. Así pues, en Italia, la terapia cuádruple con bismuto puede considerarse la mejor opción para el tratamiento empírico de primera línea.
La triple terapia estándar, a saber, IBP más claritromicina y amoxicilina o más metronidazol/tinidazol, es eficaz en las cepas sensibles a la claritromicina, pero falla cuando hay RC. La triple terapia estándar de 14 días debe utilizarse como tratamiento de primera línea sólo en zonas con una baja prevalencia conocida de RC (<15%), en pacientes que no han recibido macrólidos previamente o en zonas en las que se haya demostrado que este régimen logra altas tasas de erradicación.
El tratamiento secuencial, con IBP más amoxicilina durante 5-7 días, seguido de IBP más metronidazol y claritromicina durante 5-7 días, fue diseñado para superar el problema de la resistencia a la claritromicina. Sin embargo, los datos relativos a su eficacia son contradictorios. Las directrices recientes han desaconsejado su uso, pese a algunos informes de Italia sobre tasas de erradicación cercanas al 90%, incluso en presencia de RC. Los tratamientos de segunda línea incluyen la terapia triple con levofloxacina y la terapia cuádruple con bismuto. Se pueden utilizar suplementos probióticos para reducir los efectos adversos de los antibióticos.
9.7 América del Norte
En Norteamérica la resistencia a la claritromicina es variable (17-32% en diferentes estudios) y la resistencia al metronidazol es elevada (44%). La resistencia a la amoxicilina fue del 6% en un estudio reciente, y la resistencia a la rifabutina fue del 0%. Las directrices estadounidenses recomiendan que, para el tratamiento de primera línea, la triple terapia con claritromicina se limite a los pacientes sin antecedentes de exposición a macrólidos que vivan en zonas en las que se sabe que la resistencia a la claritromicina contra las cepas de H. pylori es baja. Algunas zonas suburbanas y rurales del país cumplen estos criterios. En la mayoría de las zonas se recomienda como tratamiento de primera línea la terapia cuádruple con bismuto o la terapia concomitante consistente en un IBP, claritromicina, amoxicilina y metronidazol. En Estados Unidos se ha aprobado una combinación de rifabutina, amoxicilina y omeprazol para el tratamiento del H. pylori. Su papel en la terapia inicial todavía no ha sido determinado.
9.8 América del Sur y Central
Los estudios sobre la resistencia a la claritromicina en América del Sur y Central siguen siendo escasos, y se han notificado algunas tasas que ya superan el 20%. Las mayores prevalencias se describen en México, Colombia, Argentina y Brasil. El uso indiscriminado de azitromicina (un fármaco de bajo costo) puede seleccionar mutantes resistentes a los macrólidos y agravar las tasas de RC. Se han documentado bajas tasas de resistencia a la amoxicilina, pero algunos estudios muestran que su porcentaje es alto en Brasil. De confirmarse esta tendencia, sería una situación alarmante, ya que estos antibióticos juegan un papel central.
El régimen triple clásico con IBP, amoxicilina y claritromicina durante 7-14 días sigue siendo el más utilizado, seguido de la terapia cuádruple con bismuto como terapia alternativa o de segunda línea y la terapia basada en levofloxacina como opción de rescate. La resistencia a la levofloxacina es escasa, pero se han descrito niveles elevados en Perú. El uso asociado de metronidazol es común para la terapia cuádruple de primera línea, pero la prevalencia reportada de resistencia es superior al 50% en Centroamérica, México y en algunos países de Sudamérica como Brasil y Colombia.
Se han notificado tasas de recurrencia superiores al 3-5% anual, con variabilidad geográfica; faltan datos de muchas regiones. Entre los obstáculos que hay que superar se encuentran el costo de la medicación, la falta de adherencia a las directrices por parte de algunos médicos, la falta de PAU en muchas regiones, el hecho que no se consiguen sales de bismuto, furazolidona y rifabutina en algunos países y la ausencia de estudios locales de alta calidad que validen los regímenes contra el H. pylori. La mayoría de los sistemas sanitarios de la región siguen funcionando de forma subóptima en estas cuestiones.
10. Abreviaturas utilizadas en esta directriz de la WGO
11. Referencias
1. Hooi JKY, Lai WY, Ng WK, Suen MMY, Underwood FE, Tanyingoh D, et al. Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis. Gastroenterology. 2017 Aug 1;153(2):420–9.
2. Kusters JG, van Vliet AHM, Kuipers EJ. Pathogenesis of Helicobacter pylori infection. Clin Microbiol Rev. 2006 Jul;19(3):449–90.
3. Chmiela M, Kupcinskas J. Review: pathogenesis of Helicobacter pylori infection. Helicobacter. 2019 Sep;24 Suppl 1:e12638.
4. Fock KM, Katelaris P, Sugano K, Ang TL, Hunt R, Talley NJ, et al. Second Asia-Pacific consensus guidelines for Helicobacter pylori infection. J Gastroenterol Hepatol. 2009 Oct;24(10):1587–600.
5. Mahachai V, Vilaichone R-K, Pittayanon R, Rojborwonwitaya J, Leelakusolvong S, Maneerattanaporn M, et al. Helicobacter pylori management in ASEAN: the Bangkok consensus report. J Gastroenterol Hepatol. 2018 Jan;33(1):37–56.
6. Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of Helicobacter pylori infection—the Maastricht V/Florence Consensus Report. Gut. 2017;66(1):6–30.
7. Coelho LGV, Marinho JR, Genta R, Ribeiro LT, Passos M do CF, Zaterka S, et al. IVth Brazilian consensus conference on Helicobacter pylori infection. Arq Gastroenterol [Internet]. 2018 Apr 16 [cited 2018 May 10]; Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0004-28032018005001101&lng=en&tlng=en
8. Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, et al. The Toronto consensus for the treatment of Helicobacter pylori infection in adults. Gastroenterology. 2016 Jul;151(1):51-69.e14.
9. Mitchell H, Katelaris P. Epidemiology, clinical impacts and current clinical management of Helicobacter pylori infection. Med J Aust. 2016 Jun 6;204(10):376–80.
10. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG clinical guideline: treatment of Helicobacter pylori infection. Am J Gastroenterol. 2017 Feb;112(2):212–39.
11. Sugano K, Tack J, Kuipers EJ, Graham DY, El-Omar EM, Miura S, et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015 Sep;64(9):1353–67.
12. Liu WZ, Xie Y, Lu H, Cheng H, Zeng ZR, Zhou LY, et al. Fifth Chinese National Consensus Report on the management of Helicobacter pylori infection. Helicobacter. 2018 Apr;23(2):e12475.
13. Goh K-L. Lessons learnt from the epidemiology of Helicobacter pylori infection in Malaysia: JGHF Marshall and Warren Lecture 2017. J Gastroenterol Hepatol. 2018 Jun;33(6):1177–84.
14. Warren JR, Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet Lond Engl. 1983;1(8336):1273–5.
15. World Health Organization. Cancer [Internet]. [cited 2021 Feb 20]. Available from: https://www.who.int/news-room/fact-sheets/detail/cancer
16. Ford AC, Yuan Y, Forman D, Hunt R, Moayyedi P. Helicobacter pylori eradication for the prevention of gastric neoplasia. Cochrane Database Syst Rev. 2020 Jul 6;7:CD005583.
17. Lazebnik LB, Bordin DS, Mikheeva OM, Belousova NL. [Eradication efficiency and Helicobacter pylori resistance to antibiotics in anticipation of IV TH Maastricht consensus issues publication. Editorial]. Exp Clin Gastroenterol. 2011;8:3–7.
18. Rugge M, Meggio A, Pennelli G, Piscioli F, Giacomelli L, De Pretis G, et al. Gastritis staging in clinical practice: the OLGA staging system. Gut. 2007 May;56(5):631–6.
19. Katelaris PH, Lowe DG, Norbu P, Farthing MJ. Field evaluation of a rapid, simple and inexpensive urease test for the detection of Helicobacter pylori. J Gastroenterol Hepatol. 1992 Dec;7(6):569–71.
20. Li Y, Lv T, He C, Wang H, Cram DS, Zhou L, et al. Evaluation of multiplex ARMS-PCR for detection of Helicobacter pylori mutations conferring resistance to clarithromycin and levofloxacin. Gut Pathog. 2020;12:35.
21. Pichon M, Pichard B, Barrioz T, Plouzeau C, Croquet V, Fotsing G, et al. Diagnostic accuracy of a noninvasive test for detection of Helicobacter pylori and resistance to clarithromycin in stool by the Amplidiag H. pylori+clarir real-time PCR assay. J Clin Microbiol. 2020 Mar 25;58(4).
22. Jehanne Q, Bénéjat L, Mégraud F, Bessède E, Lehours P. Evaluation of the AllplexTM H pylori and ClariR PCR assay for Helicobacter pylori detection on gastric biopsies. Helicobacter. 2020 Aug;25(4):e12702.
23. Savoldi A, Carrara E, Graham DY, Conti M, Tacconelli E. Prevalence of antibiotic resistance in Helicobacter pylori: a systematic review and meta-analysis in World Health Organization regions. Gastroenterology. 2018 Nov 1;155(5):1372-1382.e17.
24. Vilaichone RK, Quach DT, Yamaoka Y, Sugano K, Mahachai V. Prevalence and pattern of antibiotic resistant strains of Helicobacter pylori infection in ASEAN. Asian Pac J Cancer Prev. 2018 May 26;19(5):1411–3.
25. Kiyotoki S, Nishikawa J, Sakaida I. Efficacy of vonoprazan for Helicobacter pylori eradication. Intern Med Tokyo Jpn. 2020 Jan 15;59(2):153–61.
26. McNicholl AG, Bordin DS, Lucendo A, Fadeenko G, Fernandez MC, Voynovan I, et al. Combination of bismuth and standard triple therapy eradicates Helicobacter pylori infection in more than 90% of patients. Clin Gastroenterol Hepatol. 2020 Jan;18(1):89–98.
27. Dinis-Ribeiro M, Areia M, de Vries AC, Marcos-Pinto R, Monteiro-Soares M, O’Connor A, et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED). Endoscopy. 2012 Jan;44(1):74–94.
28. Nyssen OP, Bordin D, Tepes B, Pérez-Aisa Á, Vaira D, Caldas M, et al. European Registry on Helicobacter pylori management (Hp-EuReg): patterns and trends in first-line empirical eradication prescription and outcomes of 5 years and 21 533 patients. Gut. 2021 Jan;70(1):40–54.

















