1. Introduction
“La diarrhée chez une personne souffrant de tuberculose constitue un symptôme mortel.”
— Hippocrate, Aphorismes 5.14
“C’est impossible de diagnostiquer une tuberculose digestive avec certitude car la maladie imite tant d’autres maladies digestives et la confirmation par histologie peut s’avérer équivoque.”
— Joseph Walsh, Transactions of the National Association for the Study and Prevention of Tuberculosis 1909;5:217–22
La tuberculose (TB) est une maladie infectieuse causée par le Mycobacterium tuberculosis, qui est typiquement à l’origine d’une tuberculose pulmonaire. La TB est à la neuvième cause de mort dans la liste des causes les plus fréquentes de mortalité mondialement et constitue la première cause en relation avec un agent infectieux unique, avant même le virus de l’immunodéficience humaine/syndrome d’immunodéficience acquise (VIH/SIDA).
En 2017, 10 millions de personnes ont développé une maladie tuberculeuse et 1.6 million en sont mortes, y compris 0.3 million parmi les personnes souffrant de VIH—la tuberculose constitue la cause principale de mortalité chez les personnes VIH-positives [1].
- Environ un quart de la population du monde a une tuberculose latente.
- Les personnes infectées par la bactérie de la tuberculose ont un risque à vie de 5–15% de développer une tuberculose. Les personnes avec un système immunitaire déficient, telles les personnes qui vivent avec un VIH, de la malnutrition, le diabète, celles sous traitement avec des médicaments immunosuppresseurs et celles qui sont fumeurs, ont cependant un risque nettement plus grand de tomber malade.
- La tuberculose résistante à de multiples médicaments (MDR-TB) demeure un problème de santé publique ainsi qu’une menace pour la sécurité sanitaire. L’Organisation mondiale de la Santé (OMS/WHO) estime qu’il y avait 558’000 nouveaux patients avec une résistance à la rifampicine—le médicament de première intention le plus efficace—parmi lesquels 82% avait une tuberculose multi résistante (MDR-TB).
- L’incidence de la tuberculose est en train de diminuer d’environ 2% par année mondialement.
- Il a été estimé qu’il a été possible de sauver la vie à 60 millions de personnes par le diagnostic et le traitement entre 2000 et 2019 [1].
La tuberculose digestive est peu fréquente quand on la compare à la tuberculose pulmonaire. La tuberculose gastro-intestinale représente 2.5% des cas de tuberculose extra pulmonaire aux Etats-Unis [2].
- La maladie des ganglions lymphatiques représente la forme la plus courante de tuberculose extra pulmonaire (EPTB), tant chez les personnes avec une infection VIH que chez les patients VIH-séronégatifs.
- La tuberculose pleurale représente environ 20% des cas d’EPTB.
- La tuberculose génito-urinaire représente 10–15% des cas d’EPTB aux Etats-Unis.
Un diagnostic précoce n’est pas facile à poser en raison du tableau clinique non spécifique de la tuberculose, maladie qui peut imiter d’autres maladies gastro intestinales and qui peut varier entre les cas aigus et les cas chroniques dans les régions endémiques pour la tuberculose. Tandis que certains patients peuvent tirer bénéfice d’une thérapie antituberculeuse, d’autres peuvent développer des problèmes d’ordre chirurgical tels des sténoses, une obstruction, des fistules ou des perforations, qui peuvent nécessiter une intervention chirurgicale.
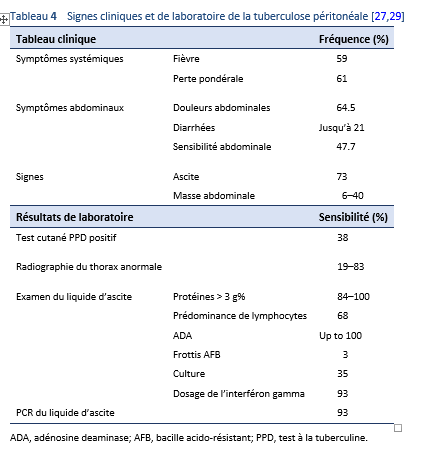
Une infection VIH constitue un facteur de risque majeur pour le développement d’une tuberculose et la tuberculose péritonéale représente un vrai défi médical chez les patients immuno déprimés en raison de ses symptômes insidieux et non spécifiques.
Bien que n’importe quelle zone de l’intestin puisse être concernée, une tuberculose du tube digestif est le plus souvent rencontrée dans la région iléo-caecale, dans l’iléon et dans le côlon. La région iléo-caecale est la région la plus souvent touchée par la tuberculose. Les explications possibles de ce fait comprennent la densité élevée du tissu lymphoïde, le ralentissement du transit intestinal et une concentration basse des acides biliaires [3].
Une péritonite tuberculeuse doit être suspectée dans tous les cas d’ascite exsudative inexpliquée. D’autres localisations possibles pour une tuberculose intestinale sont la rate, le foie et les ganglions lymphatiques [3–6].
1.1 A propos des algorithmes de la WGO
Algorithmes OMG: un ensemble hiérarchique d’options diagnostiques, thérapeutiques et de gestion pour traiter du risque et de la maladie, selon les ressources à disposition.
Les guidelines et les algorithmes OMG (WGO) sont destinés à mettre en évidence les options thérapeutiques appropriées, selon le contexte et les ressources à disposition localement pour toutes les régions géographiques indépendamment du fait qu’elles soient « en voie de développement », « déjà à moitié développées » ou « développées ». Les algorithmes OMG (WGO) fournissent des options contextuelles qui ne sont pas forcément définies uniquement selon les ressources à disposition.
Les options contenues dans les algorithmes cités ici pour le diagnostic et le traitement de la tuberculose digestive sont des facteurs clés et forment la partie la plus importante de ce document. Une attention particulière est accordée aux catégories dites « ressources élevées » (« gold-standard »), « ressources moyennes » et « ressources faibles ».
En ce qui concerne les algorithmes pour le diagnostic de la tuberculose digestive, voir Section 3.1 ci-dessous.
1.2 Définitions
- Tuberculose abdominale : tuberculose du tube digestif et de tout autre organe dans la cavité abdominale, à l’exception de la tuberculose oesophagienne.
- Tuberculose intestinale: tuberculose non péritonéale du tube digestif.
- Tuberculose péritonéale : tuberculose du péritoine.
1.3 Epidémiologie
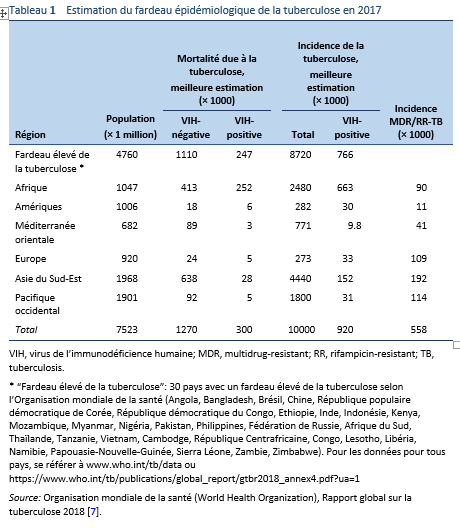
1.3.1 Rapport de l’OMS en 2018 concernant la tuberculose dans le monde [1,7]
- La tuberculose est présente partout dans le monde. En 2017, le plus grand nombre de nouveau cas de tuberculose s’est produit dans les régions de l’Asie de Sud-Est et du Pacifique occidental, avec 62% des nouveaux cas, suivis par l’Afrique avec 25% des nouveau cas.
- Bien qu’il y avait des cas de tuberculose dans tous les pays et dans tous les groupes d’âge, globalement 90% des patients étaient des adultes (âge ≥ 15 ans) et 9% étaient des personnes vivant avec le VIH (72% d’entre eux en Afrique).
- En 2017, 87% des nouveaux cas de tuberculose se sont produits dans les 30 pays avec un fardeau élevé de la tuberculose et les deux tiers se sont produits dans huit pays: Inde (27%), Chine (9%), Indonésie (8%), les Philippines (6%), Pakistan (5%), Nigéria (4%), Bangladesh (4%), et Afrique du Sud (3%).
- Seulement 6% des cas mondialement se sont produits dans les régions OMS Europe (3%) et la région OMS des Amériques (3%).
- La sévérité des épidémies nationales varie considérablement entre les pays. En 2017, il y avait moins de 10 nouveaux cas par 100’000 dans la plupart des pays à revenus élevés, 150–400 dans la plupart des 30 pays avec un fardeau élevé dû à la tuberculose et plus de 500 dans quelques pays : le Mozambique, les Philippines et l’Afrique du Sud.
- La tuberculose pharmaco-résistante constitue toujours une crise sanitaire. Trois pays représentaient à eux seuls presque la moitié des cas globalement de multidrug-resistant/rifampicine-resistant (MDR/RR) TB: l’Inde (24%), la Chine (13%), et la Fédération de Russie (10%).
- Sur le plan mondial, 3.5% des nouveaux cas de tuberculose et 18% des patients traités auparavant avait une MDR/RR-TB. Les plus fortes proportions (> 50% chez les patients traités auparavant) se trouvaient dans les pays de l’ancienne Union soviétique. En 2017, parmi les patients avec MDR-TB 8.5% (6.2% à 11%) ont été considérés comme ayant une tuberculose pharmaco-résistante extensive (XDR-TB) (intervalle de confiance de 95%).
- Les caractéristiques géographiques de la maladie sont en train de se modifier, principalement en raison de l’immigration, du VIH et du développement de souches multi-pharmaco-résistantes de la tuberculose [8].
- Dans certains pays de l’Europe de l’ouest (western countries), la tuberculose abdominale est le plus souvent « importée » plutôt qu’endogène.
- Les guidelines de l’European Crohn’s and Colitis Organization (ECCO) soulignent que le fait de passer du temps dans un pays avec une incidence élevée de la tuberculose augmente aussi le risque pour les individus [9].
L’incidence de la tuberculose intestinale (ITB) a augmenté parallèlement à l’augmentation globale de la prévalence de la tuberculose. Un parmi cinq patients avec une tuberculose dans l’Union européenne a un tuberculose extra pulmonaire [10]. L’incidence de la maladie de Crohn (MC) a également augmenté ces dernières décennies partout dans le monde, y compris dans les régions où traditionnellement la maladie a été auparavant considérée comme rare [11].
1.4 Etiopathogenèse et facteurs de risque
La tuberculose prospère partout où il existe la pauvreté et le surpeuplement ; 5–15% des 1.7 milliards de personnes estimées avoir une infection à M. tuberculosis (MTB) vont développer une tuberculose cliniquement manifeste de leur vivant [12].
La probabilité de développer une tuberculose est nettement plus grande chez les personnes avec une infection VIH et elle est également plus grande chez les personnes présentant des facteurs de risque spécifiques [13] tels que:
Autres causes d’immunosuppression—traitement par les corticostéroïdes, traitement immuno suppresseur ou chimiothérapie, à la suite d’un traitement avec un agent anti-facteur de nécrose tumorale (TNF) ou un autre traitement biologique, ainsi que chez les personnes sous dialyse péritonéale ambulatoire en continu.
Maladies invalidantes chroniques—diabète, maladies hématologiques et maladies pulmonaires chroniques, en particulier la silicose.
Malnutrition, malignité sous-jacente, cirrhose, alcoolisme.
Les patients âgés.
Les détenus et les personnes vivant dans une institution et ainsi à risque de développer une tuberculose.
Les voyages dans des pays avec une haute incidence de la tuberculose.
La tuberculose extra pulmonaire est plus fréquente chez les patients souffrant d’un VIH:
En 2016, globalement, 57% des patients avec une tuberculose avaient un test VIH-positif documenté, en hausse par rapport au 55% en 2015. Dans la région OMS Afrique, où le fardeau de la tuberculose associée au VIH est le plus grand, 82% des patients avec une tuberculose avaient un test VIH-positif documenté (en hausse par rapport au 81% de 2015) [12].
Le diagnostic d’une tuberculose peut précéder un diagnostic de SIDA de plusieurs mois; la tuberculose se dissémine souvent chez les patients avec un SIDA, progresse rapidement et est associée à un taux de mortalité élevé [14].
La tuberculose abdominale peut survenir du fait de:
Réactivation d’un foyer primaire gastro intestinal inactif:
— Par une propagation hématogène d’un foyer pulmonaire acquis pendant une infection primaire pendant l’enfance.
— Ou par l’ingestion de bacilles transportés par des macrophages à travers le système lymphatique vers les ganglions lymphatiques mésentériques où ils restent inactifs.
Ingestion de bacilles venant d’un foyer pulmonaire actif.
Propagation hématogène d’une tuberculose active dans d’autres organes.
Extension directe à partir d’organes adjacents.
Ingestion de lait infecté:
— La pratique consistant à boire du lait non pasteurisé, en particulier par les enfants qui travaillent comme bergers dans certaines parties du monde, notamment dans les régions des hauts plateaux en Pakistan et d’autres régions de l’Asie centrale, peut être à l’origine d’une tuberculose abdominale.
— Ceci n’est que rarement le cas dans les pays de l’ouest en raison de la disparition de la tuberculose bovine, de la pasteurisation du lait et la pratique consistant à bouillir le lait avant la consommation dans les pays en voie de développement.
La réactivation d’un foyer tuberculeux inactif peut être causée par une suppression immunitaire due à l’âge avancé, par une infection VIH/SIDA, un traitement anti TNF, la malnutrition, la perte du poids, l’alcoolisme, la diabète, l’insuffisance rénale chronique ainsi que d’autres maladies [12,14,15].
2. Tableau clinique
2.1 Localisations
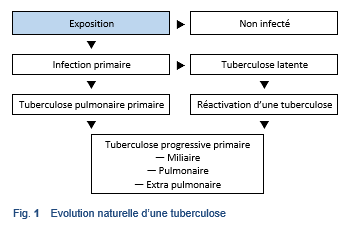
Tuberculose pulmonaire. La plupart des cas de tuberculose sont pulmonaires (Fig. 1). Parmi les patients avec une tuberculose extra pulmonaire, seulement 15–20% ont une tuberculose pulmonaire active concomitante [8]. Ce guideline ne traite pas de la tuberculose pulmonaire.
Tuberculose extra pulmonaire. La tuberculose extra pulmonaire peut concerner les localisations suivantes: le larynx, les ganglions lymphatiques, la plèvre, le cerveau, les reins, les os et les articulations, le péritoine et les intestins, les méninges, la peau et le péricarde. Les cliniciens continueront à rencontrer des cas en raison de la recrudescence de la tuberculose depuis le milieu des années 80 dans beaucoup de pays. La tuberculose extra pulmonaire se rencontre le plus souvent chez les patients avec une infection VIH ou chez d’autres patients immuno déprimés ainsi que chez les jeunes enfants. La tuberculose extra pulmonaire n’est pas traitée dans ce guideline, à l’exception de la tuberculose abdominale.
Tuberculose miliaire. Une troisième forme de tuberculose, cependant rare, est la tuberculose miliaire, où les particules tuberculeuses sont disséminés dans toutes les parties du corps par la circulation sanguine. Ce guideline ne traite pas de la tuberculose miliaire.
Tuberculose abdominale. La tuberculose peut impliquer n’importe quelle partie du tube digestif, de la bouche jusqu’à l’anus (49%), le péritoine (42%), les ganglions lymphatiques mésentériques (4%), et les viscères solides, y compris le foie et le système pancréatico biliaire (5%) [13,16]. Le siège la plus fréquent de la tuberculose intestinale est la région iléo-caecale, suivie du côlon et du jéjunum.
- La tuberculose abdominale se rencontre principalement chez les jeunes adultes.
- Dans une grande série de cas, la tuberculose du tube digestif était localisée dans la partie haute du tube dans 8.5% de cas, dans l’intestin grêle dans 33.8% de cas, dans le gros intestin dans 22.3% de cas, dans le péritoine dans 30.7% de cas et dans le foie dans 14.6% de cas [17].
2.2 Symptômes et signes physiques
Les symptômes et les signes de la tuberculose gastro-intestinale et péritonéale sont non spécifiques et de ce fait le diagnostic risque d’être manqué ou retardé—avec pour résultat une morbidité et une mortalité accrues.
La plupart des patients souffrant d’une tuberculose abdominale présentent des symptômes qui durent déjà depuis un mois à une année, tels des douleurs abdominales, un amaigrissement, une perte pondérale généralisée, une anorexie, une fièvre, des diarrhées, une constipation, des rectorragies et un œdème [18]. Les symptômes sont généralement d’une intensité modérée.
La présence d’une tuberculose pulmonaire coexistante augmente considérablement la fréquence de fièvre et de sueurs nocturnes, d’une perte pondérale et de symptômes pulmonaires.
La tuberculose peut être associée à des manifestations auto-immunes telles un érythème noueux (un érythème induré), une arthrite réactionnelle (maladie de Poncet) et une uvéite, qui peuvent tous initialement faire penser à des manifestations extra intestinales d’une maladie de Crohn [19–22].
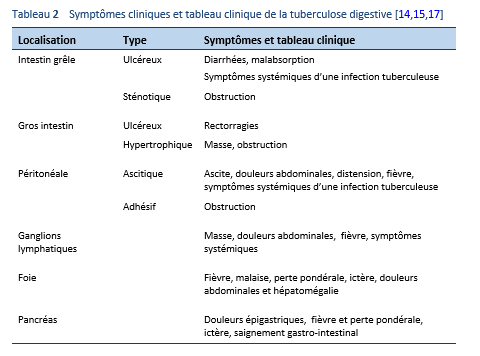
L’examen physique peut révéler une pâleur, une ascite ou un abdomen de consistance pâteuse ainsi qu’une sensibilité abdominale généralisée, tout particulièrement dans la fosse iliaque droite. Il peut y avoir également une hépatomégalie et des masses abdominales liées à l’atteinte hépatique, une hypertrophie des ganglions lymphatiques, une adhérence des anses intestinales ou un abcès froid [13].
Les symptômes et les signes cliniques pour une tuberculose abdominale sont non spécifiques et peuvent faire penser à une maladie de Crohn et à une autre pathologie gastro-intestinale. La tuberculose peut être confondue avec un cancer des zones concernées. Une tuberculose intestinale a parfois été identifiée chez des patients asymptomatiques qui subissent une coloscopie pour d’autres raisons.
Le mode de présentations le plus fréquent est la douleur (dans environ 85% des cas), une perte pondérale (66%), la fièvre (35–50%) et les diarrhées (20%).
- Des manifestations systémiques sont retrouvées chez 30% de patients, telle une fièvre légère, une hausse de la température le soir, une léthargie, un malaise, des sueurs nocturnes et une perte pondérale. Ces manifestations sont le plus souvent trouvées chez les patients avec la forme ascitique d’une tuberculose péritonéale et avec des lésions ulcéreuses de l’intestin.
- Une sensibilité abdominale est retrouvée chez la plupart des patients ainsi qu’une masse abdominale, plus typiquement dans le quadrant inférieur droit chez 25–50% de patients.
- Il peut exister une malabsorption chez 21–75% de patients [4].
- Abdomen aigu: dans les pays en voie de développement, une tuberculose extra pulmonaire (abdominale) peut se présenter sous forme d’un abdomen aigu dans le cadre d’une urgence chirurgicale telle une perforation ou une obstruction de l’intestin [4].
- Une ascite peut avoir une tuberculose péritonéale pour origine ou peut provenir d’une maladie hépatique, d’un cancer, d’une maladie cardiaque ou rénale ainsi que d’autres maladies infectieuses [23].
- Une tuberculose péritonéale avec ascite peut se présenter avec moins de sensibilité et de défense musculaire qu’une péritonite pyogène avec perforation.
- Un cocon abdominal est une forme peu commune de la tuberculose abdominale et est caractérisé par la formation d’un sac de type membranaire fibreux autour des anses de l’intestin grêle. Chez certains patients, un traitement conservateur avec un antituberculeux peut suffire, tandis que les patients qui ne répondent pas à un tel traitement nécessitent une intervention chirurgicale [24].
- Une tuberculose ano rectale peut se présenter sous forme de sténose, de fistule in ano ou de fissure anale.
- Une tuberculose gastrique peut faire penser à un ulcère peptique ou à un carcinome, ou bien se présenter sous forme de perforation ou d’obstruction gastro-pylorique. Elle se présente le plus souvent sous forme de fistules de la muqueuse antrale plutôt que dans le corps de l’estomac et assez souvent en présence d’une sténose pylorique.
- Tuberculose duodénale: les patients souffrant d’une tuberculose duodénale présentent souvent avec une symptomatologie d’obstruction en raison de sténoses luminales [25], ainsi qu’avec une anamnèse de dyspepsie. Une infiltration sous muqueuse sans nécrose claire des ganglions lymphatiques peut cependant se produire.
- Tuberculose oesophagienne: rare; symptômes généraux, dysphagie, odynophagie, gêne rétro sternale, douleurs [18]; peut être confondue avec un cancer des zones concernés.
- Une tuberculose iléocaecale et de l’intestin grêle peut se présenter avec des complications tells une obstruction intestinale, parfois des fistules avec le côlon ou la vessie, une perforation ou une malabsorption, tout particulièrement en présence d’une sténose.
- Tuberculose rectale: l’hématochésie est le symptôme le plus commun, suivi de symptômes généraux et d’une constipation; une sténose annulaire peut être mise en évidence au toucher rectal avec des zones focales d’ulcération profonde.
- Une tuberculose hépatique est habituellement insidieuse et non spécifique. Le patient se présente avec l’anamnèse d’une maladie prolongée, associée souvent à la fièvre, un malaise, une perte pondérale, un ictère, des douleurs abdominales et une hépatomégalie. L’atteinte hépatique peut être sous forme granulomateuse, ou comme faisant partie d’une tuberculose miliaire ou sous forme d’une atteinte hépatique avec un abcès localisé. Il peut y avoir une atteinte des voies biliaires en raison de ganglions lymphatiques hypertrophiés tuberculeux qui peuvent être à l’origine d’un ictère obstructif.
— Le plus souvent le foie n’est pas sensible lors de la percussion ou de la palpation.
— Dans certains cas, il peut y avoir une splénomégalie.
— Les patients souffrent habituellement d’une anémie.
— Il peut y avoir un ictère léger, qui peut devenir sévère par la suite.
- La tuberculose pancréatique se retrouve le plus souvent chez les femmes.
— Les symptômes peuvent comprendre des douleurs épigastriques, de la fièvre et une perte pondérale ; il peut y avoir ou non un ictère.
— D’autres présentations cliniques peuvent comprendre une pancréatite aiguë ou chronique et un saignement gastro intestinal secondaire à une thrombose splénique ou de la veine porte.
— Elle doit être suspectée chez des jeunes patients avec une masse pancréatique ou des ganglions lymphatiques hypo denses dans la région péri pancréatique, tout particulière s’ils souffrent d’une fièvre sans ictère, s’ils habitant dans une région où la tuberculose est endémique, ou s’ils ont été exposés à la tuberculose dans le passé.
Dans le diagnostic différentiel de maladies gastro-intestinales inhabituelles, il faut toujours suspecter la présence d’une tuberculose, tout particulièrement dans les régions où la tuberculose est hautement endémique.
Sources: [4,17,18,23] et d’autres citations mentionnées dans le texte ci-dessus.
3. Diagnostic
3.1 Algorithmes pour établir un diagnostic de tuberculose gastro-intestinale
Algorithmes des options/alternatives selon le contexte et le niveau de ressources à disposition pour les pays et les régions avec des niveaux de ressources et d’accès aux soins différents, ainsi que des cultures et une épidémiologie différentes.

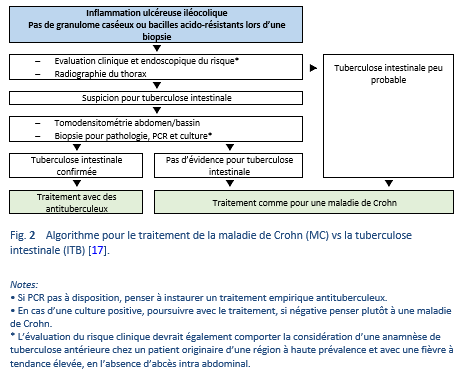
Il n’existe actuellement pas d’examens dits de référence (“gold standard”) pour le diagnostic d’une infection tuberculeuse latente et pour la détection précoce d’une tuberculose active ; par conséquent, il n’y a pas d’examen unique qui soit adéquat pour établir un diagnostic de tuberculose abdominale chez tous les patients. Le diagnostic d’une tuberculose abdominale chez les patients non-VIH demeure toujours un dilemme qui nécessite un haut niveau de suspicion clinique [16].
Dans les régions endémiques [4] et dans certaines situations spécifiques dans les pays développés telles chez les patients VIH et les patients sous traitement avec des médicaments immuno suppresseurs ou biologiques, il faudrait toujours considérer une tuberculose abdominale lors du diagnostic différentiel d’un abdomen aigu ou chronique.
Il est possible de poser un diagnostic définitif de tuberculose digestive en présence d’un des quatre critères suivants[26]:
- Cultures de tissus (biopsies coliques, des ganglions lymphatiques) positives pour M. tuberculosis
- Présence histologiquement de bacilles acido-résistants typiques (AFB)
- Evidence à l’histologie d’un granulome caséeux
- GeneXpert MTB rifampicine (RIF) assay/TB polymerase chain reaction (PCR) sur un prélèvement par biopsie.
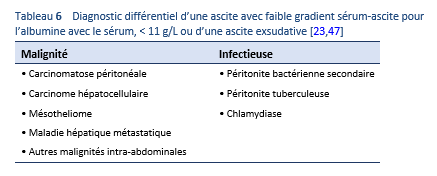
Dans le cas d’une ascite exsudative (protéines > 2,5 g/dL) avec une prédominance de lymphocytes et/ou le gradient sérum-ascite pour l'albumine de < 1.1 mg/dL, il conviendrait de prendre en considération un diagnostic de tuberculose péritonéale dans le cadre du diagnostic différentiel. Les taux d’adénosine deaminase sont élevés. Une confirmation par examen microbiologique ou pathologique demeure la technique de référence (« gold standard”) pour établir un diagnostic [27].
Un diagnostic de tuberculose intestinale [28] devrait se baser sur:
- Au moins huit biopsies prises pendant une coloscopie pour évaluation histopathologique.
- Analyse des tissus et culture pour détection de bacilles acido-résistants (AFB)—un résultat positif sur n’importe lequel de ces examens suffirait pour pouvoir poser le diagnostic; un résultat négatif ne permet cependant pas d’exclure un diagnostic de tuberculose intestinale.
- Un examen des tissus par PCR est recommandé et un résultat positif peut être considéré comme significatif.
— Un examen rétrospectif des échantillons antérieurs peut être effectué.
— Un résultat négatif ne permet pas d’exclure un diagnostic de tuberculose.
- Un test à la tuberculine purifiée (PPD) et un dosage de la libération d’interféron gamma positif (IGRA : interféron gamma release assay ; test de détection de l’interféron gamma pour la détection de l’infection tuberculeuse latente).
— Un test PPD positif est souvent constaté dans les pays en voie de développement, y compris dans la maladie de Crohn et dans d’autres origines potentielles d’une ascite.
— Les tests PPD ou IGRA sont utilisés dans des pays à ressources élevées afin de diagnostiquer une éventuelle exposition antérieure à la tuberculose.
— Il n’est pas possible d’établir un diagnostic de tuberculose abdominale par des tests PPD ou IGRA, en particulier dans les pays en voie de développement où il existe une exposition élevée à la tuberculose et où la vaccination contre le bacille Calmette–Guérin (BCG) est courante.
3.2 Investigations
Malgré les progrès réalisés sur le plan du diagnostic, une partie importante des cas de tuberculose signalés à l’Organisation Mondiale de la Sante sont toujours diagnostiqués cliniquement plutôt que d’être confirmés bactériologiquement, en raison d’un manque de financement ou un manque de compétences locales. En 2016, <60% des cas de tuberculose pulmonaire signalés à l’OMS étaient confirmés bactériologiquement [12].
3.2.1 Tests de laboratoire de routine
Chez 50–80% de patients, les tests de laboratoire de routine révèlent une légère anémie et une augmentation de la vitesse de sédimentation, tandis que la formule leucocytaire est habituellement normale [18].
3.2.2 Examens radiologiques
La tomodensitométrie (CT) après ingestion d’un produit de contraste constitue la meilleure modalité radiologique pour l’évaluation d’une éventuelle pathologie intra luminale ou extra luminale et permet de visualiser la localisation et l’étendue du processus inflammatoire et l’atteinte de l’intestin, du mésentère, du péritoine, des ganglions lymphatiques et des organes solides, ainsi que du l’atteinte rétro péritonéale [17,18,30]. Elle permet de distinguer entre une ascite carcinomateuse et une tuberculose péritonéale. La présence de ganglions lymphatiques nécrotiques permet de poser un diagnostic de tuberculose péritonéale. Le cas échéant, une entérographie par CT permet de détecter et de constater l’atteinte de l’intestin grêle.
Ultrasonographie. L’ultrasonographie endoscopique (EUS) peut permettre la visualisation des différentes lésions proches de la lumière gastro-intestinale ainsi que leur aspiration ou biopsie en pratiquant une aspiration à l’aiguille fine guidée par EUS ou une biopsie [31]. Des biopsies ciblées des ganglions lymphatiques, du foie et du pancréas peuvent également être effectuées [32]. L’ultrasonographie endoscopique (EUS) s’avère utile pour l’imagerie de la tuberculose péritonéale [18].
Imagerie par résonance magnétique (IRM/MRI) ne permet pas de détecter de petites calcifications au sein des ganglions ou des masses et n’est pas utile pour faire la différence entre la maladie de Crohn et la tuberculose intestinale.
Radiographie du thorax. Une radiographie du thorax négative ne permet pas d’exclure une tuberculose abdominale.
3.2.3 Endoscopie
Une endoscopie avec prise de biopsies peut s’avérer utile afin de diagnostiquer une tuberculose intestinale à condition qu’il soit possible d’atteindre la région atteinte avec un endoscope flexible. Il n’est pas rare que celle-ci n’est pas prise en considération jusqu’à son diagnostic lors du geste opératoire [8]. Une entéroscopie à double ballonnet peut être utile pour prendre des biopsies. Dans le cas d’un infiltrat duodénal sans ulcère manifeste, effectuer une polypectomie après ligature peut s’avérer utile afin d’obtenir des biopsies d’une meilleure qualité [25].
- Il est possible de poser un rapide diagnostic de tuberculose intestinale si des bacilles résistants à l’acide ou des granulomes caséeux sont identifiés dans les prélèvements lors de biopsies.
- Dans le cas d’une tuberculose péritonéale, une endoscopie devrait être effectuée afin de pouvoir exclure un cancer digestif primaire (ascite carcinomateuse).
- Une entéroscopie et une endoscopie par capsule peuvent être utiles afin d’évaluer une pathologie de l’intestin grêle mais il faut éviter d’effectuer une endoscopie par capsule chez les patients chez qui une sténose est suspectée.
3.2.4 Laparoscopie
Une laparoscopie avec prise de biopsies peut être effectuée afin de pouvoir poser un diagnostic de tuberculose péritonéale, mais son utilisation est moins claire dans le cas d’une tuberculose intestinale [17]. Une laparoscopie avec biopsie dirigée permet de poser un diagnostic spécifique et rapide [8].
- Les constatations d’une laparoscopie diagnostique peuvent comprendre : un épaississement du péritoine, une ascite, des nodules blanchâtres, des ganglions lymphatiques, des adhésions fibrotiques et une hépatomégalie.
- Un enveloppement de l’intestin par les graisses est peu fréquent dans la tuberculose intestinale [33,34] et sa présence favoriserait plutôt un diagnostic de maladie de Crohn.
3.2.5 Histopathologie
Dans le cas d’une tuberculose, les biopsies révèlent des bacilles acido-résistants ou des granulomes caséeux, mais la coloration des bacilles acido-résistants manque de sensibilité et de spécificité. Distinguer entre la maladie de Crohn et la tuberculose n’est jamais tout à fait simple et les deux maladies peuvent coexister, bien que cela soit rare, en particulier dans le cadre d’un traitement biologique.
La tuberculose intestinale est une maladie sous-muqueuse et poser un diagnostic par endoscopie avec biopsie de la muqueuse n’est ainsi pas facile et le rendement diagnostique est faible (bacilles acido-résistants, PCR positive, granulomes caséeux ou culture positive pour tuberculose). Pulimood et al ont décrit un tableau de caractéristiques histologiques pour des biopsies qui, en absence de bacilles acido-résistants et d’une inflammation granulomateuse caséeuse, représentent des facteurs permettant de poser un diagnostic de tuberculose intestinale [35–37]. Sont également compris des granulomes confluents, la présence de multiples granulomes à un endroit particulier, des granulomes de grande taille, des bandes d’histiocytes épithélioïdes bordant les ulcères, des granulomes sous-muqueux et une inflammation sous muqueuse disproportionnée—c’est-à-dire une inflammation sous muqueuse qui dépasse largement l’inflammation de la muqueuse.
Les constatations histopathologiques peuvent comprendre des modifications inflammatoires non spécifiques:
- Les échantillons pour biopsie sont essentiellement récoltés pendant un geste chirurgical, une coloscopie, une tomodensitométrie, ou lors d’une biopsie guidée par ultrason, une laparoscopie et une oeso-gastro-duodénoscopie.
- La tuberculose est une maladie inflammatoire chronique granulomateuse, mais il n’y aurait pas forcément des granulomes dans un échantillon donné.
- Les lésions intestinales peuvent être ulcéreuses (60%), hypertrophiques (10%), et ulcéro-hypertrophiques (30%) [13].
- En cas de forte suspicion pour une tuberculose, les échantillons de biopsie devraient être envoyés pour examen microbiologique [31] et analyse moléculaire.
Des frottis pour germes acido-résistants par microscopie devraient être pratiqués à partir des liquides biologiques chez des patients avec une suspicion de tuberculose abdominale.
- La plupart des études rapportent un niveau de négativité élevé dans les expectorations, dans les urines et dans les échantillons d’ascite. Il est possible que la probabilité d’une positivité d’un frottis acido-résistant puisse augmenter en fonction du nombre de sites biopsiés [4].
- Il s’agit d’une technique développée il y a plus de 100 ans, les échantillons d’expectorations étant examinés à l’aide d’un microscope afin de relever la présence de bactéries. Dans les définitions de cas actuelles de l’OMS, un seul résultat positif est nécessaire afin de pouvoir poser un diagnostic d’une tuberculose pulmonaire positive lors d’un frottis.
- Il n’est pas recommandé d’effectuer une recherche de bacilles acido-résistants dans les selles, étant donné que la présence de mycobactéries non tuberculeuses commensales peut conduire à un diagnostic faussement positif de tuberculose intestinale.
3.2.6 Microbiologie
Méthodes basées sur la culture. Ces méthodes représentent actuellement les examens de référence. Elles nécessitent des capacités de laboratoire plus élaborées ; les cultures de biopsie pour MTB prennent du temps (de 3–8 semaines et même parfois jusqu’à 12 semaines pour avoir un résultat) [12], et les résultats sont souvent négatifs (avec un taux de précision allant de 25% à 35% [17] et même encore plus bas selon quelques études).
3.2.7 Résultats des tests sérologiques
Tests moléculaires rapides. L’OMS ne recommande actuellement qu’un seul test rapide pour le diagnostic d’une tuberculose: Xpert® MTB/RIF assay (Cepheid, Sunnyvale, California, USA).
- Les résultats sont à disposition dans les deux heures et le test était initialement recommandé (en 2010) pour le diagnostic d’une tuberculose pulmonaire chez les adultes. Depuis 2013, il a également été recommandé pour utilisation chez les enfants et pour le diagnostic de certaines formes spécifiques de tuberculose extra pulmonaire. Ce test dispose d’un niveau de précision beaucoup plus élevé par rapport à l’examen de frottis d’expectorations par microscopie [12].
- Pour le diagnostic de tuberculose abdominale, un article de revue indien a fait état d’une étude de Delhi chez les patients avec une tuberculose intestinale et montre une sensibilité basse pour le diagnostic d’une tuberculose intestinale: seuls trois des 37 patients (8%) avaient un résultat positif avec le test Xpert. Dans le cas de tuberculose péritonéale, deux études ont également fait état d’un niveau de sensibilité bas du test Xpert, avec 12 cas sur 67 cas positifs (17.9%) dans une série et quatre sur 21 (19%) cas dans une autre série étant positif avec le test Xpert [38].
- En 2015, une méta-analyse de 36 études a fait état d’un niveau élevé de spécificité mais d’un niveau de sensibilité limité pour Xpert pour la détection d’une tuberculose extra-pulmonaire (EPTB). Un résultat positif par Xpert peut être utile afin de permettre l’identification rapide des cas de tuberculose extra-pulmonaire, mais les résultats négatifs n’offrent moins de certitude pour l’exclusion de la maladie [39].
- Une étude en 2018 a analysé l’utilisation du test GeneXpert MTB/RIF pour le diagnostic d’une tuberculose abdominale (rapportant des données de 21 patients) et a fait état d’une sensibilité de 28.57% pour GeneXpert et d’une spécificité de 0%. Dans leur étude, les auteurs ont conclus que GeneXpert montrait un niveau de sensibilité et de spécificité faibles pour la détection d’une tuberculose abdominale dans les échantillons de liquide d’ascite.
Dosage de la libération d’interféron-gamma (IGRA). IGRA se base sur la stimulation d’une réponse immune cellulaire par des antigènes immuno dominants ESAT-6 et CFP10 spécifiques au bacille de la tuberculose, et représente un alternatif diagnostique au test cutané à la tuberculine.
Options du test IGRA:
- Test QuantiFERON-TB Gold In-Tube (QFT, Qiagen, Hilden, Allemagne), basé sur un échantillon de sang complet. L’exactitude de ce test est réduite chez les patients sous immuno suppresseurs [40].
- Test T-SPOT.TB (enzyme-linked immunospot/ELISPOT, Oxford Immunotec, Abingdon, Royaume-Uni), basé sur les cellules mononucléaires de sang périphérique purifié.
Différentes études ont confirmé la valeur informative de ces tests pour diagnostiquer la tuberculose et l’émergence de tests IGRA peut conduire à une meilleure moyen d’identifier une tuberculose latente (LTBI) [41].
Les principaux avantages de ces tests sont:
- Une vaccination antérieure par le BCG n’a aucun effet sur leur efficacité.
- Il n’existe pas de réaction croisée avec la plupart des mycobactéries non tuberculeuses.
- Une seule et unique consultation est nécessaire.
Les désavantages de ces tests sont:
- Leur coût élevé (>US$ 100 ou plus) peut représenter un obstacle à leur usage dans les pays à ressources faibles.
- Ils nécessitent un laboratoire spécialement aménagé, un personnel qualifié et des procédures invasives.
- Les tests IGRA ne permettent pas de distinguer entre une tuberculose active et une tuberculose latente.
- Un test IGRA négatif ne permet pas d’exclure une tuberculose latente.
- Les tests ne peuvent pas prédire la progression d’une tuberculose latente [11].
Bien qu’il soit actuellement toujours difficile à déterminer la supériorité entre les IGRA et le test cutané à la tuberculine, les deux sont affectés négativement par un traitement simultané immuno suppresseur. Il faudrait par conséquent penser à effectuer un dépistage avant l’instauration d’un traitement par immuno suppresseurs. Un dépistage devrait impérativement être effectué pour chaque patient chez qui un traitement anti-TNF est prévu [40].
Les tests IGRA peuvent être effectués dans le cadre d’une évaluation globale des risques afin de pouvoir identifier les patients qui nécessiteraient un traitement à but préventif (par exemple, les patients immuno déprimés, les enfants, les proches et les patients récemment exposés) [42], mais les tests IGRA ne conviennent pas dans le cadre d’études de dépistage à grande échelle, et en particulier chez les enfants, en raison des désavantages cités ci-dessus.
La détermination des taux d’interféron-gamma dans le liquide d’ascite peut représenter un technique potentielle pour le futur dans le diagnostic de la tuberculose péritonéale [27].
Le European Centre for Disease Prevention & Control (ECDC) vient de publier les lignes directrices suivantes en ce qui concerne l’utilisation d’un test de libération de l’interféron-gamma afin d’appuyer le diagnostic de la tuberculose [42]:
- Les tests IGRA ne devraient pas se substituer aux méthodes diagnostiques standards (de la microbiologie, des tests moléculaires et une évaluation clinique et radiologique) pour le diagnostic d’une tuberculose active.
- Les tests IGRA ne représentent pas une valeur ajoutée dans la plupart des situations cliniques en combinaison avec les méthodes diagnostiques standards pour le diagnostic d’une tuberculose active.
- Cependant, basé sur les rares données à disposition, dans certaines situations cliniques (par exemple chez les patients avec une tuberculose extra pulmonaire, les patients avec un test négatif pour les bacilles acido-résistants dans les expectorations et/ou une culture négative pour M. tuberculosis, le diagnostic d’une tuberculose chez les enfants ou dans le diagnostic différentiel d’une infection par une mycobactérie non tuberculeuse) les test IGRA peuvent se révéler utiles en tant que source d’informations dans le cadre d’un bilan diagnostique. Un test IGRA négatif ne permet pas d’exclure une tuberculose active.
- Sur la base des données actuellement à disposition en ce qui concerne la valeur prédictive positive pour l’évaluation de la progression tout en tenant compte leur valeur statistiquement faible, et du petit nombre d’études, les tests IGRA peuvent être utilisés dans le cadre d’une évaluation des risques globaux afin d’identifier les patients qui nécessiteraient un traitement à but préventif (par exemple, les patients immuno déprimés, les enfants, les proches et les patients récemment exposés).
- Malgré les limitations des études actuellement à disposition, le taux prédictif négatif élevé des IGRA pour évaluer la progression indique qu’au moment du test et dans le cadre d’une évaluation des risques globale, la progression vers une tuberculose active chez les patients immuno compétents sains avec des tests IGRA négatifs est très peu probable. Les tests IGRA peuvent donc être utilisés dans ce contexte.
- Il conviendrait de noter qu’un test IGRA négatif ne permet pas d’exclure une LTBI, en particulier chez les groupes à risque et dans certaines situations spécifiques.
3.2.8 Amplification en chaîne par polymérase (PCR)
PCR. Le test PCR pour tuberculose sur les échantillons de biopsie récoltés lors d’une endoscopie ou dans le cadre d’un geste chirurgical chez les patients avec une tuberculose intestinale s’est révélé hautement précis pour diagnostiquer une tuberculose intestinale, avec une spécificité de <95% et une fiabilité de 82.6% [17].
- Une méta-analyse en 2017 a conclu que le test PCR pour MTB représente une méthode diagnostique hautement spécifique afin de distinguer entre tuberculose intestinale et maladie de Crohn (CD). Un résultat négatif ne permet cependant pas d’exclure une ITB, en raison de la faible sensitivité du test [43].
- L’utilisation du test PCR dans le liquide d’ascite peut s’avérer utile dans le cadre d’une tuberculose péritonéale [29].
3.2.9 Test à la tuberculine
PPD. Le dérivé protéique purifié (PPD) représente une version avancée du test cutané à la tuberculine (TST). Il se base sur les composants protéiques des filtrats de culture du MTB et est utilisé afin de diagnostiquer une infection tuberculeuse (latente).
- Le résultat des injections intradermiques de 0.1 mL de PPD devrait être lu après 48–72 heures.
- En cas d’un premier test négatif, il conviendrait de répéter le test dans 1–3 semaines.
- Le test PPD s’avère positif dans environ 70% de patients, mais un résultat négatif ne permet néanmoins pas à exclure la maladie.
Un test PPD peut s’avérer faussement négatif secondaire à:
- L’activation des cytokines dans le cadre d’une maladie active.
- La présence d’une anergie dans le cadre d’une autre maladie à l’origine d’une immuno dépression—par exemple un VIH ou une autre infection virale.
- Une tuberculose sévère, c’est-à-dire disséminée.
- Tout traitement immuno suppresseur.
- Une mauvaise alimentation.

La valeur diagnostique d’un test cutané PPD pour tuberculose intestinale n’est pas certaine et les résultats obtenus sont influencés en fonction de la prévalence de la tuberculose dans la population étudiée [13,15,17]:
- Un test positif dans une population à haute prévalence (> 20 par 100’000/année) est plus susceptible pour une infection tuberculeuse vraie et peut s’avérer faussement positif dans une population à faible prévalence (< 10 par 100’000/année).
- Dans les régions dans lesquelles la vaccination BCG est toujours pratiquée, le taux de résultats faussement positif est très élevé.
La valeur diagnostique est également limitée chez les patients avec une réponse immunitaire affaiblie au moment du test PPD. Ceci peut être dû à:
— Une infection VIH
— Une tuberculose primaire, disséminée
— L’utilisation de corticostéroïdes ou d’immuno modulateurs
3.2.10 Adénosine deaminase
Adénosine deaminase (ADA) est un marqueur enzymatique fiable pour l’ascite tuberculeuse. Une valeur seuil d’entre 36 et 40 IU/L possède un haut degré de sensibilité (100%) et de spécificité (97%) pour le diagnostic d’une tuberculose péritonéale [23,44].
- L’évaluation par ADA d’une ascite représente un test relativement sensible et spécifique pour le diagnostic d’une péritonite tuberculeuse—les données regroupées de sensibilité et de spécificité pour le diagnostic d’une péritonite tuberculeuse étaient de 0.93 (95% CI, 0.89 à 0.95) et 0.96 (95% CI, 0.94 à 0.97), respectivement dans une méta-analyse de 16 études [45] et de 0.93 et 0.94 respectivement dans une étude comprenant les données de 17 études dans 1’797 patients [46].
- Dans les pays occidentaux, et en particulier chez les groupes de patients à haut risque, l’adénosine deaminase (ADA) peut également remplacer d’autres méthodes plus invasives.
- Une évaluation par adénosine deaminase (ADA) n’est peut-être pas généralement à disposition dans les centres de santé.
- En particulier dans les régions sous-développées, où un examen par laparoscopie ne peut être pratiqué et où la tuberculeuse est endémique, l’évaluation d’une ascite par adénosine deaminase (ADA) représente un outil important pour le diagnostic d’une péritonite tuberculeuse [8].
3.2.11 Tests diagnostiques reconnus par l’OMS
Détection moléculaire de la tuberculose et de la pharmaco résistance
- Xpert MTB/RIF Ultra pour la détection de la tuberculose et une résistance à rifampicine dans les échantillons pulmonaires, extra pulmonaires et pédiatriques (Cepheid, Sunnyvale, California, Etats-Unis)
- Test d’hybridation inverse en ligne pour la détection de Mycobacterium tuberculosis (MTB), résistance à isoniazide et résistance à rifampicine dans les frottis d’expectorations aux bacilles acido-résistants ou des cultures MTB (FL-LPA) (Hain Lifescience GmbH, Nehren, Allemagne et Nipro, Osaka, Japon)
- Test d’hybridation inverse en ligne pour la détection de la résistance aux fluoro quinolones et les agents injectables de deuxième intention (SL-LPA) (Hain Lifescience GmbH)
- TB LAMP pour la détection de la tuberculose (Eiken Chemical Co., Ltd., Tokyo, Japon)
Techniques non moléculaires
- Alere Determine TB-LAM (Alere International Ltd., Galway, Irlande)—pour la détection de la tuberculose chez les patients gravement atteints dans le cadre d’un VIH
- Test de libération d’interféron gamma (IGRA) pour le diagnostic d’une infection tuberculeuse latente (LTBI) (Oxford Immunotec, Abingdon, Royaume-Uni; Qiagen, Germantown, Maryland, Etats-Unis)
Techniques par cultures
- Systèmes de cultures liquides disponibles et de spéciation rapide
- Tests phénotypiques de sensibilité aux médicaments par culture (DST) avec proportion critique de 1% LJ,7H10,7H11 et pour déterminer la croissance mycobactérienne (MGIT)
Microscopie
- Microscopie photonique et par diodes électroluminescentes (pour le diagnostic et pour le suivi du traitement) [12]
3.3 Diagnostic différentiel
3.3.1 Tuberculose péritonéale
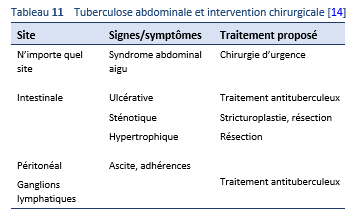
Diagnostic différentiel basé sur le genre de lésion [14]:
- Ascitique: causes d’une ascite exsudative—par exemple ascite carcinomateuse, syndrome de Budd–Chiari
- Tuberculeux: carcinomatose
3.3.2 Tuberculose intestinale
Diagnostic différentiel basé sur le type de lésion [14]:
- Ulcéreuse: Maladie de Crohn, jéjunite ulcéreuse (maladie cœliaque réfractaire de type 2), sprue tropicale, maladie de l’intestin grêle immuno proliférative
- Sténotique: Maladie de Crohn, tumeur maligne (adénocarcinome et lymphome), ischémique
- Hypertrophique: carcinome du caecum, masse appendiculaire, granulome amibien, actinomycose, maladie de Crohn
- Perforations: typhoïde, maladie de Crohn
- Fistules: maladie de Crohn
3.3.3 Tuberculose et maladie de Crohn
La maladie de Crohn (CD) est une maladie inflammatoire idiopathique avec un fond génétique certain et qui est modifiée par de multiples facteurs environnementaux [17]. Son diagnostic se base sur une association de facteurs cliniques et de caractéristiques endoscopiques et histologiques [26].
De même que pour l’incidence de la tuberculose, l’incidence de la maladie de Crohn dans les régions endémiques pour la tuberculose est également en augmentation [17,48,49].
- Une étude venant d’Arabie saoudite rapporte une augmentation de l’incidence moyenne annuelle pour la maladie de Crohn sur deux décennies de 0.32/100,000 à 1.66/100,000; des résultats similaires ont également été trouvés dans une population pédiatrique dans la même région.
- Dans une étude libanaise sur les années 2000–2004, l’incidence moyenne annuelle était de 1.4/100,000; des résultats similaires ont également été observés en Iran, en Asie et en Amérique du Sud.
- Une étude épidémiologique sur la maladie de Crohn et sur la colite dans la région de l’Asie-Pacifique (Asia–Pacific Crohn’s and Colitis Epidemiology Study), étude sur une population à large échelle dans huit pays d’Asie et d’Australie, les valeurs pour l’incidence brute annuelle générale pour les individus étaient:
— Pour l’Asie: 1.37/100,000 pour la maladie inflammatoire de l’intestin (IBD), 0.76/100,000 pour la colite ulcéreuse (UC), 0.54/100,000 pour la maladie de Crohn (CD) et 0.07/100,000 pour une maladie inflammatoire de l’intestin indéterminée.
— Pour l’Australie: 23.67/100,000 pour IBD, 7.33/100,000 pour UC, 14.00/100,000 pour la maladie de Crohn (CD), et 2.33/100,000 pour la maladie inflammatoire de l’intestin non déterminée.
— En Asie, la Chine avait l’incidence la plus élevée de maladie intestinale inflammatoire (IBD) à 3.44/100,000.
— Les rapports de UC et CD étaient de 2.0 en Asie et 0.5 en Australie [48].

Une maladie inflammatoire digestive (IBD) constitue un diagnostic différentiel important tant dans les pays développés que dans les pays en voie de développement. Dans les pays en voie de développement et où la tuberculose est endémique avec un taux élevé d’infections latentes, le dépistage afin de détecter une éventuelle exposition chez les individus autrement en bonne santé n’est pas approprié.
3.3.4 Autres diagnostics à considérer
- Pseudo myxome péritonéal
- Lymphomatose péritonéale
- Léiomyomatose péritonéale diffuse
- Splénose bénigne
4. Traitement
4.1 Traitement médicamenteux de la tuberculose extra pulmonaire
Les patients avec une tuberculose abdominale devraient bénéficier d’un traitement antituberculeux complet.
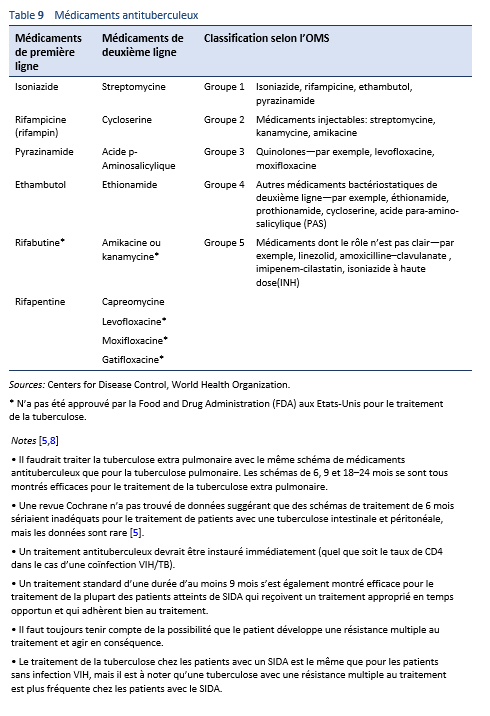
Un traitement de 2 mois comme indiqué dans le Tableau 8 est actuellement recommandé pour une tuberculose intestinale non compliquée. Il faut éviter d’effectuer un traitement plus long car il est associé à un faible degré de compliance et à un risque accru d’effets secondaires de médicaments potentiellement toxiques.

4.2 Effets secondaires
L’isoniazide (INH), la rifampicine (RIF), ou le pyrazinamide (PZA) peuvent provoquer une hépato toxicité.
- Une hépatite d’origine médicamenteuse peut être soit asymptomatique soit symptomatique [15].
- Chez les patients asymptomatiques celle-ci est définie par un taux de sérum aspartate transaminase (AST) à 5 x la limite supérieure de la normale.
- Chez les patients symptomatiques (qui présentent le plus souvent des douleurs abdominales, des nausées, des vomissements) celle-ci est définie par une AST à 3 x la limite supérieure de la norme.
- Chez un patient qui se présente aux urgences avec une augmentation significative de l’AST, le traitement médicamenteux doit être interrompu.
Surveillance d’une hépato toxicité d’origine médicamenteuse (DIH) ou une lésion du foie d’origine médicamenteuse (DILI) [11]
- Chez les patients sous un traitement antituberculeux avec des médicaments de première ligne, il conviendrait d’effectuer une mesure de référence des enzymes hépatiques (transaminases, bilirubine, et phosphatase alcaline).
- Il conviendrait d’exclure la présence d’une hépatite virale aiguë (hépatite B ou C) chez les patients à risque sur le plan épidémiologique.
- Il conviendrait d’effectuer une mesure des enzymes hépatiques de façon répétée—toutes les deux semaines pendant les trois premiers mois, puis mensuellement—dans les situations suivantes (mais ceci n’est pas nécessaire en cas d’une mesure de référence normale):
— Mesure de référence anormale
— Suspicion d’une hépato toxicité d’origine médicamenteuse
— Maladie hépatique (par exemple, hépatite B ou C, abus d’alcool)
— Grossesse et dans les premiers trois mois postpartum
— Traitement combiné comportant le pyrazinamide dans la phase de continuation
- Les symptômes d’une éventuelle hépato toxicité peuvent comprendre: une anorexie, des nausées, des vomissements, une urine très foncée, un ictère, une éruption cutanée, un prurit, une fatigue, une fièvre, un gène abdominal (en particulier dans le quadrant supérieur droit), apparition facile d’ecchymoses ou des saignements, d’arthralgies.
— Les patients doivent être informés sur les symptômes potentiels.
— Il faudrait interroger les patients concernant les éventuels symptômes à chaque contrôle mensuel.
— Les patients devraient informer le médecin immédiatement en cas d’apparition de signes ou de symptômes entre les contrôles mensuels.
- Facteurs prédictifs d’une hépato toxicité d’origine médicamenteuse:
— Age > 35 années (augmentation du risque par quatre fois pour le développement d’une TB DILI)
— Sexe féminine
— Hépatite B (augmentation du risque de quatre fois chez les porteurs d’HBsAg versus non porteurs)
— Hépatite C (augmentation du risque par cinq fois)
— Consommation d’alcool
— Cirrhose
— Alimentation: circonférence à mi-bras de < 20 cm, hypo albuminémie lors de la mesure de référence
— Polymorphisme génétique (dans les pays en voie de développement ceci n’est pas étudié en tant de facteur de risque pour une hépato toxicité)
D’autres effets secondaires médicamenteux possibles : symptômes gastro-intestinaux, éruption cutanée et interactions médicamenteuses.
4.3 Résistance bactérienne
Une multi résistance aux médicaments (Multidrug resistance (MDR)) a été observée dans 2.4–13.2% des souches de MTB chez des patients chez lesquels on diagnostique récemment une tuberculose pulmonaire et chez 17.4–25.5% des patients précédemment traités. Une résistance étendue aux médicaments (XDR) est presque exclusivement rencontrée chez des patients ayant déjà reçu un traitement et représente environ 6% des cas de multi-résistance.
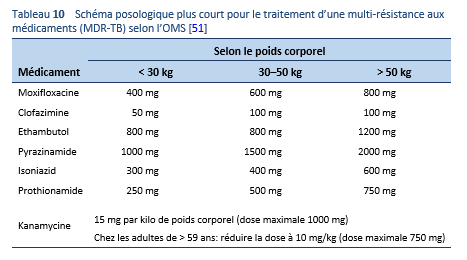
Schéma de traitement plus court pour les cas de multi-résistance selon l’OMS:
- Kanamycine (agent injectable), moxifloxacine, prothionamide, clofazimine, isoniazide, pyrazinamide et ethambutol, administrés ensemble dans une phase initiale de 4 mois (avec la possibilité de prolonger le traitement jusqu’à 6 mois au cas où le patient a toujours un résultat positif lors d’un frottis des expectorations au terme du mois 4).
- Avec ensuite une phase de traitement intensive de 5 mois avec quatre de ces médicaments (moxifloxacine, clofazimine, pyrazinamide, et ethambutol).
- Prise unique des médicaments 1x/jour 7/7 jours.
- En cas de prolongation de la phase de traitement intensive, l’agent injectable n’est donné que 3x/semaine après le quatrième mois.
4.4 Traitement empirique
Un traitement empirique avec un médicament antituberculeux pendant 2–3 mois pourrait être approprié dans les pays avec une prévalence haute de tuberculose abdominale si les facteurs cliniques sont également compatibles—c’est-à-dire si les données cliniques, radiographiques et endoscopiques concordent avec un diagnostic de tuberculose abdominale et si d’autres maladies fréquentes telles le cancer, une maladie inflammatoire de l’intestin non spécifique et d’autres infections spécifiques peuvent être raisonnablement exclus [13].
Le diagnostic d’une entérite tuberculeuse peut être considéré comme hautement probable si le patient démontre une réponse au traitement et si aucune récidive ne survient à la fin du suivi [8].
Une surveillance de la réponse au traitement devrait se faire chaque semaine pendant 4–6 semaines:
- Disparition des symptômes
- Prise pondérale
- L’amélioration de l’hémoglobine et une baisse des taux de la protéine C-réactive (CRP) sont à considérer comme plus sensibles qu’une baisse de la vitesse de sédimentation pour déterminer la réponse à un traitement antituberculeux [52].
Il est cependant recommandé d’établir le diagnostic de tuberculose avant de commencer un traitement, pour les raisons suivantes [11,17]:
- Une réponse partielle à un traitement antituberculeux chez les patients atteints d’une maladie de Crohn et l’émergence d’une tuberculose multi résistante aux médicaments peut restreindre l’utilité de la réponse à un traitement antituberculeux en tant de moyen d’établir un diagnostic de tuberculose.
- Un traitement antituberculeux peut avoir des effets secondaires significatifs ainsi qu’un risque de morbidité.
- Les patients avec une maladie de Crohn sous traitement immunosuppresseur ont un risque plus élevé de contracter des infections, y compris la tuberculose—cela peut conduire à une coexistence des deux maladies.
Si une laparoscopie n’est pas envisageable ou n’est pas abordable financièrement, et si les patients ne peuvent pas être opérés, un test ADA de l’ascite peut se révéler crucial afin de pouvoir poser rapidement un diagnostic de tuberculose péritonéale et d’instaurer un traitement empirique avec des médicaments antituberculeux.
Chez les patients avec un index élevé pour une suspicion de tuberculose péritonéale et avec une adénosine deaminase (ADA) > 30 UI, un traitement antituberculeux peut être instauré.
4.5 Tuberculose et maladie de Crohn
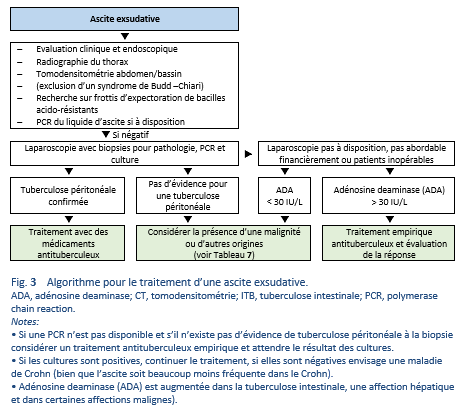
4.6 Traitement chirurgical
Une intervention chirurgicale ne devrait se faire qu’en cas de complications—fibrose, sténoses, et abdominal aigu—ou en cas de doute du point de vue diagnostique.
5. Appendice
5.1 Abréviations

5.2 Guidelines sur la tuberculose et les affections gastro-intestinales
- European Centre for Disease Prevention and Control. Use of interferon-gamma release assays in support of TB diagnosis. Stockholm: ECDC; 2011. doi: 10.2900/38588. Available from: https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/1103_GUI_IGRA.pdf [42].
- [Diagnostic guideline of intestinal tuberculosis]. [In Korean.] Kim YS, Kim Y-H, Lee K-M, Kim JS, Park YS, IBD Study Group of the Korean Association of the Study of Intestinal Diseases. Korean J Gastroenterol. 2009;53(3):177–86 [53].
- The diagnostic work-up in patients with ascites: current guidelines and future prospects. Oey RC, van Buuren HR, de Man RA. Neth J Med. 2016;74(8):330–5 [23].
- Index-TB guidelines: guidelines on extrapulmonary tuberculosis for India. Sharma SK, Ryan H, Khaparde S, Sachdeva KS, Singh AD, Mohan A, et al. Indian J Med Res. 2017;145(4):448–63. Available from: https://www.ijmr.org.in/article.asp?issn=0971-5916;year=2017;volume=145;issue=4;spage=448;epage=463;aulast=Sharma;type=2 [54].
- Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. Rahier JF, Magro F, Abreu C, Armuzzi A, Ben-Horin S, Chowers Y, et al. J Crohns Colitis. 2014;8(6):443–68. Available at https://academic.oup.com/ecco-jcc/article/8/6/443/421810 [9].
5.3 Références
1. World Health Organization. Tuberculosis: key facts [Internet]. Geneva: World Health Organization; 2020 [cited 2021 Mar 31]. Available from: https://www.who.int/news-room/fact-sheets/detail/tuberculosis
2. Raviglione MC. Tuberculosis. In: Jameson JL, Fauci AS, Kasper DL, Hauser SL, Longo DL, Loscalzo J, editors. Harrison’s Principles of Internal Medicine. 20th ed. New York: McGraw-Hill Education; 2018. p. 1236–58.
3. Epstein D, Mistry K, Whitelaw A, Watermeyer G, Pettengell KE. The effect of physiological concentrations of bile acids on in vitro growth of Mycobacterium tuberculosis. S Afr Med J. 2012;102(6):522–4.
4. Pattanayak S, Behuria S. Is abdominal tuberculosis a surgical problem? Ann R Coll Surg Engl. 2015;97(6):414–9.
5. Jullien S, Jain S, Ryan H, Ahuja V. Six-month therapy for abdominal tuberculosis. Cochrane Database Syst Rev. 2016;11:CD012163.
6. Noomene R, Ouakaa A, Jouini R, Maamer AB, Cherif A. What remains to surgeons in the management of abdominal tuberculosis? A 10 years experience in an endemic area. Indian J Tuberc. 2017;64(3):167–72.
7. World Health Organization. Global tuberculosis report 2018 [Internet]. Geneva: World Health Organization; 2018. Available from: https://apps.who.int/iris/handle/10665/274453
8. Marshall JB. Tuberculosis of the gastrointestinal tract and peritoneum. Am J Gastroenterol. 1993;88(7):989–99.
9. Rahier JF, Magro F, Abreu C, Armuzzi A, Ben-Horin S, Chowers Y, et al. Second European evidence-based consensus on the prevention, diagnosis and management of opportunistic infections in inflammatory bowel disease. J Crohns Colitis. 2014;8(6):443–68.
10. European Centre for Disease Prevention and Control. Extrapulmonary tuberculosis — a challenging diagnosis [video] [Internet]. European Centre for Disease Prevention and Control. 2013 [cited 2018 Sep 24]. Available from: http://ecdc.europa.eu/en/publications-data/extrapulmonary-tuberculosis-challenging-diagnosis
11. Sood A, Midha V, Singh A. Differential diagnosis of Crohn’s disease versus ileal tuberculosis. Curr Gastroenterol Rep. 2014;16(11):418.
12. World Health Organization. Global tuberculosis report 2017 [Internet]. Geneva: World Health Organization; 2017 [cited 2018 Jul 26]. Available from: http://www.who.int/tb/publications/global_report/en/
13. Abbas Z. Abdominal tuberculosis. In: Hasan M, Akbar MF, Al-Mahtab M, editors. Textbook of Hepato-Gastroenterology. New Delhi: Jaypee Brothers Medical Pub; 2015. p. 68–76.
14. Kapoor VK. Abdominal tuberculosis. Postgrad Med J. 1998;74(874):459–67.
15. Wang E, Sohoni A. Tuberculosis: a primer for the emergency physician. Emerg Med Rep [Internet]. 2006 Dec 24 [cited 2018 Jul 28]; Available from: https://www.reliasmedia.com/articles/100438-tuberculosis-a-primer-for-the-emergency-physician
16. Khan R, Abid S, Jafri W, Abbas Z, Hameed K, Ahmad Z. Diagnostic dilemma of abdominal tuberculosis in non-HIV patients: an ongoing challenge for physicians. World J Gastroenterol. 2006;12(39):6371–5.
17. Almadi MA, Ghosh S, Aljebreen AM. Differentiating intestinal tuberculosis from Crohn’s disease: a diagnostic challenge. Am J Gastroenterol. 2009;104(4):1003.
18. Rathi P, Gambhire P. Abdominal tuberculosis. J Assoc Physicians India. 2016;64(2):38–47.
19. Kroot EJA, Hazes JMW, Colin EM, Dolhain RJEM. Poncet’s disease: reactive arthritis accompanying tuberculosis. Two case reports and a review of the literature. Rheumatol Oxf Engl. 2007;46(3):484–9.
20. Umapathy KC, Begum R, Ravichandran G, Rahman F, Paramasivan CN, Ramanathan VD. Comprehensive findings on clinical, bacteriological, histopathological and therapeutic aspects of cutaneous tuberculosis. Trop Med Int Health. 2006;11(10):1521–8.
21. Kurup SK, Chan CC. Mycobacterium-related ocular inflammatory disease: diagnosis and management. Ann Acad Med Singapore. 2006 Mar;35(3):203–9.
22. Figueira L, Fonseca S, Ladeira I, Duarte R. Ocular tuberculosis: position paper on diagnosis and treatment management. Rev Port Pneumol. 2017;23(1):31–8.
23. Oey RC, van Buuren HR, de Man RA. The diagnostic work-up in patients with ascites: current guidelines and future prospects. Neth J Med. 2016;74(8):330–5.
24. Sharma V, Singh H, Mandavdhare HS. Tubercular abdominal cocoon: systematic review of an uncommon form of tuberculosis. Surg Infect. 2017;18(6):736–41.
25. Puri AS, Sachdeva S, Mittal VV, Gupta N, Banka A, Sakhuja P, et al. Endoscopic diagnosis, management and outcome of gastroduodenal tuberculosis. Indian J Gastroenterol. 2012;31(3):125–9.
26. Moka P, Ahuja V, Makharia G. Endoscopic features of gastrointestinal tuberculosis and Crohn’s disease. J Dig Endosc. 2017;8(1):1–11.
27. Vaid U, Kane GC. Tuberculous peritonitis. Microbiol Spectr. 2017;5(1).
28. Yönal O, Hamzaoğlu HO. What is the most accurate method for the diagnosis of intestinal tuberculosis? Turk J Gastroenterol. 2010;21(1):91–6.
29. Portillo-Gómez L, Morris SL, Panduro A. Rapid and efficient detection of extra-pulmonary Mycobacterium tuberculosis by PCR analysis. Int J Tuberc Lung Dis. 2000;4(4):361–70.
30. Mao R, Liao W, He Y, Ouyang C, Zhu Z, Yu C, et al. Computed tomographic enterography adds value to colonoscopy in differentiating Crohn’s disease from intestinal tuberculosis: a potential diagnostic algorithm. Endoscopy. 2015;47(4):322–9.
31. Sharma V, Rana SS, Ahmed SU, Guleria S, Sharma R, Gupta R. Endoscopic ultrasound-guided fine-needle aspiration from ascites and peritoneal nodules: A scoping review. Endosc Ultrasound. 2017;6(6):382–8.
32. Vafa H, Arvanitakis M, Matos C, Demetter P, Eisendrath P, Toussaint E, et al. Pancreatic tuberculosis diagnosed by EUS: one disease, many faces. JOP J Pancreas. 2013;14(3):256–60.
33. Pulimood AB. Differentiation of Crohn’s disease from intestinal tuberculosis in India in 2010. World J Gastroenterol. 2011;17(4):433–43.
34. Ko JK, Lee HL, Kim JO, Song SY, Lee KN, Jun DW, et al. Visceral fat as a useful parameter in the differential diagnosis of Crohn’s disease and intestinal tuberculosis. Intest Res. 2014 Jan;12(1):42–7.
35. Kirsch R. Role of colonoscopic biopsy in distinguishing between Crohn’s disease and intestinal tuberculosis. J Clin Pathol. 2006;59(8):840–4.
36. Pulimood AB, Peter S, Ramakrishna B, Chacko A, Jeyamani R, Jeyaseelan L, et al. Segmental colonoscopic biopsies in the differentiation of ileocolic tuberculosis from Crohn’s disease. J Gastroenterol Hepatol. 2005;20(5):688–96.
37. Pulimood AB, Ramakrishna BS, Kurian G, Peter S, Patra S, Mathan VI, et al. Endoscopic mucosal biopsies are useful in distinguishing granulomatous colitis due to Crohn’s disease from tuberculosis. Gut. 1999;45(4):537–41.
38. Dawra S, Mandavdhare HS, Singh H, Sharma V. Abdominal tuberculosis: diagnosis and management in 2018. J Indian Acad Clin Med. 2017;18(4):271–4.
39. Penz E, Boffa J, Roberts DJ, Fisher D, Cooper R, Ronksley PE, et al. Diagnostic accuracy of the Xpert® MTB/RIF assay for extra-pulmonary tuberculosis: a meta-analysis. Int J Tuberc Lung Dis. 2015;19(3):278–84, i–iii.
40. Shahidi N, Fu Y-TN, Qian H, Bressler B. Performance of interferon-gamma release assays in patients with inflammatory bowel disease: A systematic review and meta-analysis. Inflamm Bowel Dis. 2012;18(11):2034–42.
41. Starshinova A, Zhuravlev V, Dovgaluk I, Panteleev A, Manina V, Zinchenko U, et al. A comparison of intradermal test with recombinant tuberculosis allergen (Diaskintest) with other immunologic tests in the diagnosis of tuberculosis infection. Int J Mycobacteriology. 2018;7(1):32–9.
42. European Centre for Disease Prevention and Control. Use of interferon-gamma release assays in support of TB diagnosis: ad hoc scientific panel opinion [Internet]. Stockholm: European Centre for Disease Prevention and Control; 2011. (ECDC guidance). Available from: https://ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/1103_GUI_IGRA.pdf
43. Jin T, Fei B, Zhang Y, He X. The diagnostic value of polymerase chain reaction for Mycobacterium tuberculosis to distinguish intestinal tuberculosis from Crohn’s disease: a meta-analysis. Saudi J Gastroenterol. 2017;23(1):3–10.
44. Riquelme A, Calvo M, Salech F, Valderrama S, Pattillo A, Arellano M, et al. Value of adenosine deaminase (ADA) in ascitic fluid for the diagnosis of tuberculous peritonitis: a meta-analysis. J Clin Gastroenterol. 2006;40(8):705–10.
45. Shen Y, Wang T, Chen L, Yang T, Wan C, Hu Q, et al. Diagnostic accuracy of adenosine deaminase for tuberculous peritonitis: a meta-analysis. Arch Med Sci. 2013;9(4):601–7.
46. Tao L, Ning H-J, Nie H-M, Guo X-Y, Qin S-Y, Jiang H-X. Diagnostic value of adenosine deaminase in ascites for tuberculosis ascites: a meta-analysis. Diagn Microbiol Infect Dis. 2014;79(1):102–7.
47. Garcia-Tsao G. Ascites. In: Dooley JS, Lok AS, Garcia-Tsao G, Pinzani M, editors. Sherlock’s diseases of the liver and biliary system. 13th ed. Hoboken, NJ: Wiley; 2018. p. 127–50.
48. Ng SC, Tang W, Ching JY, Wong M, Chow CM, Hui AJ, et al. Incidence and phenotype of inflammatory bowel disease based on results from the Asia–Pacific Crohn’s and Colitis Epidemiology Study. Gastroenterology. 2013;145(1):158-165.e2.
49. Kaplan GG. The global burden of IBD: from 2015 to 2025. Nat Rev Gastroenterol Hepatol. 2015;12(12):720–7.
50. He Y, Zhu Z, Chen Y, Chen F, Wang Y, Ouyang C, et al. Development and validation of a novel diagnostic nomogram to differentiate between intestinal tuberculosis and Crohn’s disease: a 6-year prospective multicenter study. Am J Gastroenterol. 2019;114(3):490–9.
51. World Health Organization. WHO consolidated guidelines on drug-resistant tuberculosis treatment [Internet]. Geneva: World Health Organization; 2018 [cited 2021 Mar 30]. Available from: https://www.who.int/tb/publications/2019/consolidated-guidelines-drug-resistant-TB-treatment/en/
52. Lawn SD, Obeng J, Acheampong JW, Griffin GE. Resolution of the acute-phase response in West African patients receiving treatment for pulmonary tuberculosis. Int J Tuberc Lung Dis. 2000;4(4):340–4.
53. Kim YS, Kim Y-H, Lee K-M, Kim JS, Park YS, IBD Study Group of the Korean Association of the Study of Intestinal Diseases. [Diagnostic guideline of intestinal tuberculosis]. Korean J Gastroenterol. 2009;53(3):177–86.
54. Sharma SK, Ryan H, Khaparde S, Sachdeva KS, Singh AD, Mohan A, et al. Index-TB guidelines: guidelines on extrapulmonary tuberculosis for India. Indian J Med Res. 2017;145(4):448–63.


















