1.1 История и определения
Более века тому назад Илья Мечников (русский ученый, Нобелевский лауреат и профессор Пастеровского института в Париже) постулировал, что молочнокислая бактерия (МКБ) благотворно влияет на состояние здоровья и способствует долголетию. Он предположил, что «кишечная аутоинтоксикация», и вызываемое ею старение, может быть уменьшена модификацией кишечной микробиоты и замещением протеолитических микробов — которые продуцируют токсические вещества, включающие фенолы, индолы и аммиак при переваривании белков — полезными микробами. Мечников разработал диету с включением молока, ферментированного бактерией, которую он назвал «Болгарской бациллой».
Появились и другие ранние разработки этой концепции. В попытке изменить или заместить кишечную микробиоту при лечении нарушений в пищеварительном тракте использовались живые непатогенные бактерии. В 1917 г., до того, как сэр Александр Флеминг открыл пенициллин, немецкий ученый Альфред Ниссле изолировал непатогенный штамм Escherichia coli, который не вызывал развития энтероколита во время серьезной вспышки шигеллеза, из фекалий солдата, воевавшего на Первой Мировой войне. Полученный штамм Escherichia coli Nissle 1917 – один из немногих примеров пробиотика, не связанного с МКБ.
Анри Тиссье (Пастеровский институт) впервые изолировал Bifidobacterium от новорожденного на грудном вскармливании для последующего ее введения детям, страдающим диареей. Он выдвинул гипотезу о возможности замещений этой бактерией протеолитических бактерий, вызывающих диарею. В Японии, д-р Минору Широта изолировал штамм Shirota Lactobacillus casei для борьбы со вспышками диареи. Пробиотический продукт с этим штаммом выпускается с 1935 г.
Таким были ранние предшественники работ на развившемся впоследствии целом научном поле. Сегодня, поиск в PubMed клинических исследований на человеке показывает более 1500 опубликованных результатов работ по пробиотикам и почти 350 по пребиотикам. Хотя эти исследования гетерогенны в отношении штамма (штаммов) тестируемых пребиотиков и включенных популяций, собранные доказательства подтверждают точку зрения на то, что положительные эффекты поддаются измерению при множестве различных конечных результатов.
Пробиотики – это живые микроорганизмы, приносящие пользу хозяину при введении в адекватных количествах [1] (Таблица 1). Как пробиотики чаще всего используются виды Lactobacillus (Рис. 1) и Bifidobacterium, но также эту роль играют и дрожжи Saccharomyces boulardii и некоторые виды E. coli и Bacillus. Недавно, как новый пищевой продукт, в Европейском Союзе была зарегистрирована Clostridium butyricum. Молочнокислые бактерии, включая вид Lactobacillus, ферментация которых в течение тысяч лет использовалась для сохранения пищи, могут действовать и как средство для ферментации и, в дополнение к этому, потенциально способны оказывать благотворный эффект на состояние здоровья. Тем не менее, строго говоря, термин «пробиотик» должен резервироваться для живых микробов, которые показали положительные эффекты на состояние здоровья в контролируемых клинических исследованиях на человеке. Понятие «ферментация» во всем мире употребляется в отношении сохранения множества сырых сельскохозяйственных продуктов (круп, кореньев, клубней, овощей и фруктов, молока, мяса, рыбы и т.д.).


1.2 Пребиотики и синбиотики
Концепция пребиотиков возникла значительно позже, чем пробиотиков, и впервые была предложена Gibson и Roberfroid в 1995 г. [2]. Ключевые аспекты пребиотиков заключаются в том, что они не перевариваются в ЖКТ хозяина, и в том, что они оказывают благоприятное воздействие на состояние здоровья индивидуума посредством влияния на собственные полезные для хозяина микробы. Целью введения или использования пребиотиков или пробиотиков является оказание влияния на кишечную среду, заселенную миллиардами симбиотических микробов, для положительного влияния на здоровье человека. Как пробиотики, так и пребиотики показали свои положительные эффекты, выходящие за пределы желудочно-кишечного тракта, но данные рекомендации будут сфокусированы их на воздействии на кишечник.
Пребиотики – это диетарные вещества (в основном состоящие из некрахмальных полисахаридов и олигосахаридов). Большинство пребиотиков используются как пищевые ингредиенты – например, в печенье, кашах, шоколаде, спредах и молочных продуктах. Самые известные пребиотики - это:
- Олигофруктоза
- Инулин
- Галакто-олигосахариды
- Лактулоза
- Олигосахариды грудного молока
Лактулоза – это синтетический дисахарид, применяемый как препарат для лечения запоров и печеночной энцефалопатии. Естественная пребиотическая олигофруктоза обнаруживается во многих пищевых продуктах, таких как пшеница, лук, бананы, мед, чеснок и лук-порей. Также олигофруктоза может быть выделена из корня цикория или энзиматически синтезирована из сукрозы.
Ферментация олигофруктозы в толстой кишке приводит к большому количеству физиологических эффектов, включающих:
- Увеличение количества бифидобактерий в толстой кишке
- Усиление всасывания кальция
- Увеличение веса фекалий
- Уменьшение времени транзита по желудочно-кишечному тракту
- Возможное снижение уровня липидов в крови
Предполагается, что увеличение количества кишечных бифидобактерий оказывает положительный эффект на здоровье человека за счет выработки компонентов, ингибирующих потенциальные патогены, снижения уровня аммиака в крови и продукции витаминов и пищеварительных ферментов.
Синбиотики представляют собой соответствующую комбинацию пребиотиков и пробиотиков. Синбиотический продукт обладает как пробиотическими, так и пребиотическими качествами.
1.3 Типы, виды и штаммы, используемые как пробиотики
Пробиотический штамм идентифицируется типом, видом, подвидом (если применимо) и буквенно-цифровым обозначением специфического штамма. В научном сообществе существует общепринятая номенклатура для микроорганизмов – например, Lactobacillus casei DN-114 001 или Lactobacillus rhamnosus GG. Маркетинговые и торговые названия научным сообществом не контролируются. В соответствии с практическими рекомендациями ВГО/FAO (http://www.fao.org/3/a-a0512e.pdf), производители пробиотика должны регистрировать их штаммы в международном депозитарии. Депозитарии дают дополнительные обозначения штаммов. В Таблице 2 даны несколько примеров коммерческих штаммов и связанных с ними названий.

Использование обозначений штаммов для пробиотиков очень важно, так как самым надежным подходом к доказательству эффективности пробиотика служит связь положительных влияний (например, в отношении желудочно-кишечного тракта, обсуждаемых в данных практических рекомендациях) со специфическими штаммами или комбинацией штаммов пробиотиков в эффективной дозировке.
Рекомендации для применения пробиотиков, особенно в клинических условиях, должны связывать специфические штаммы с заявленными эффектами, основанными на исследованиях на человеке. У некоторых штаммов имеются уникальные качества, которые могут отвечать за определенные неврологические, иммунологические и антимикробные эффекты. Тем не менее, новой концепцией в сфере пробиотиков служит понимание того, что некоторые механизмы пробиотической активности, вероятно, являются общими для различных штаммов, видов и даже типов. Многие пробиотики могут действовать сходным образом в отношении способности к стимуляции резистентности к колонизации, регулирования желудочно-кишечного транзита, или нормализации нарушений в микробиоте. Например, способность к увеличению продукции короткоцепочечных жирных кислот или к снижению pH просвета толстой кишки могут быть главным эффектом, производимым многими различными штаммами пробиотиков. Следовательно, некоторые пробиотические эффекты могут быть оказаны многими штаммами определенных хорошо изученных видов Lactobacillus и Bifidobacterium. Если целью приема пробиотиков является поддержка здорового пищеварения, то, возможно, будет достаточным употребление многих разнообразных пробиотических смесей, содержащих адекватное количество хорошо изученных видов.
Сейчас в сфере изучения пробиотиков общепринятым считается включать в системные обзоры и мета-анализы множественные штаммы. Такой подход возможен, если общие механизмы действия различных включенных штаммов позволяют считать их ответственными за полученный эффект.
1.4 Колонизация микробиоты
Функции и пробиотиков и пребиотиков пересекаются с микробами, колонизирующими человеческий организм. Пребиотики служат источником питания для полезных членов симбиотического микробного содружества и, следовательно, положительно влияют на состояние здоровья. Перекрестные действия между пробиотиками и клетками хозяина, или между пробиотиками и присутствующими микробами, представляют собой главные средства влияния на здоровье хозяина.
Кишечник содержит огромной количество микробов, которые в основном населяют толстую кишку и представляют сотни видов (Таблица 3). По оценкам в толстой кишке взрослого человека существуют более 40 миллиардов бактериальных клеток (включая малую долю архей (архибактерий), менее 1%). Также присутствуют, с ничтожным вкладом в отношении количества клеток, грибки и протисты, в то время как количество вирусов/фагов может превышать количество бактерий. В целом, кишечные микробы добавляют в среднем 600,000 геном каждому человеческому организму.
На уровне видов и штаммов, микробное расхождение между отдельными индивидуумами довольно значительно: каждый человек имеет свою четкую картину бактериальной композиции, частично обусловленную его генотипом, первичной колонизацией при рождении путем вертикальной передачи и диетическими привычками.
У здоровых взрослых людей фекальная композиция стабильна на протяжении времени. В экосистеме человеческого кишечника доминируют две бактериальные группы —Bacteroidetes и Firmicutes—и представляют собой 90% всех микробов. Остающиеся 10% - это Actinobacteria, Proteobacteria, Verrucomicrobia и Fusobacteria.
Нормальным взаимодействием между кишечными бактериями и их хозяином являются симбиотические отношения. Наличие важного влияние кишечных бактерий на иммунную функцию можно предположить по присутствию большого количества организованных лимфоидных структур в слизистой оболочке тонкого кишечника (Пейеровы бляшки) и толстого кишечника (изолированные лимфоидные фолликулы). Эпителий над этими структурами специализирован на захвате и сэмплировании антигенов, и содержит лимфоидные герминальные центры для индукции адаптивных иммунных ответов. В толстой кишке микроорганизмы пролиферируют, ферментируя доступные вещества из пищи или эндогенной секреции, таким образом внося свой вклад в питание хозяина.
Многие исследования показали, что у здоровых индивидуумов и людей с наличием заболевания или патологического состояния популяции колонизирующих микробов различаются. Тем не менее, исследователи все еще не способны четко очертить композицию здоровой микробиоты человека. Некоторые симбиотические бактерии (такие как Roseburia, Akkermansia, Bifidobacterium и Faecalibacterium prausnitzii) представляются более тесно связанными со здоровьем, но определение того, может ли добавление этих бактерий улучшить состояние здоровья и способствовать разрешению заболевания является в настоящее время активной областью исследований.

1.5 Механизмы действия пробиотиков
Пребиотики влияют на бактерии ЖКТ путем увеличения количества полезных анаэробных бактерий и снижения популяции потенциально патогенных микроорганизмов. Пробиотики действуют на экосистему ЖКТ, влияя на иммунные механизмы в слизистой оболочке, взаимодействуя с симбиотическими или потенциально патогенными микробами, генерируя продукты метаболического обмена, такие как короткоцепочечные жирные кислоты и коммуницируя с клетками хозяина посредством химических сигналов (Рис. 2; Таблица 4). Эти механизмы могут приводить к антагонизму с потенциальными патогенами, улучшению среды ЖКТ, укреплению желудочно-кишечного барьера, отрицательной обратной связи с воспалением и обратной связи с иммунным ответом на антигенные вызовы. Предположительно эти феномены оказывают наиболее положительные эффекты, включающие снижение частоты и тяжести диареи, которая является одной из самых частых причин применения пробиотиков.


5.1 Общие ссылки
AlFaleh K, Anabrees J. Probiotics for prevention of necrotizing enterocolitis in preterm infants. Cochrane Database Syst Rev 2014;(4):CD005496. doi: 10.1002/14651858.CD005496.pub4. PubMed PMID: 24723255.
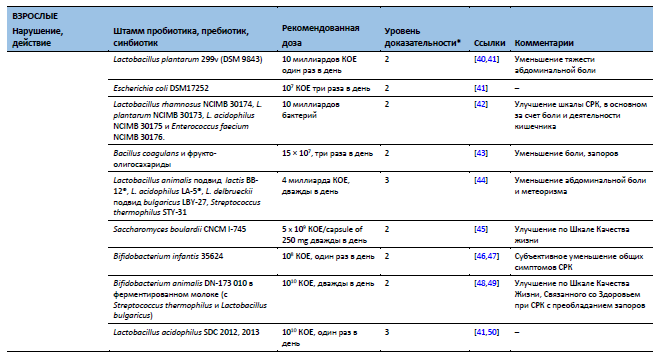
Bäckhed F, Fraser C, Ringel Y, Sanders ME, Sartor RB, Sherman PM, et al. Defining a healthy human gut microbiome: current concepts, future directions, and clinical applications. Cell Host Microbe 2012;12:611–22.
Bernaola Aponte G, Bada Mancilla CA, Carreazo NY, Rojas Galarza RA. Probiotics for treating persistent diarrhoea in children. Cochrane Database Syst Rev 2013;(8):CD007401. doi: 10.1002/14651858.CD007401.pub3. PubMed PMID: 23963712.
Bindels LB, Delzenne NM, Cani PD, Walter J. Towards a more comprehensive concept for prebiotics. Nat Rev Gastroenterol Hepatol 2015;12:303–10. doi: 10.1038/nrgastro.2015.47. Epub 2015 Mar 31. PubMed PMID: 25824997.
Floch MH, Walker WA, Sanders ME, Nieuwdorp M, Kim AS, Brenner DA, et al. Recommendations for probiotic use — 2015 update: proceedings and consensus opinion. J Clin Gastroenterol 2015;49 Suppl 1:S69–73. doi: 10.1097/MCG.0000000000000420. PubMed PMID: 26447969.
Gibson GR, Roberfroid MB. Dietary modulation of the colonic microbiota: introducing the concept of prebiotics. J Nutr 1995;125:1401–12.
Goldenberg JZ, Lytvyn L, Steurich J, Parkin P, Mahant S, Johnston BC. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database Syst Rev 2015;(12):CD004827. doi:10.1002/14651858.CD004827.pub4. PubMed PMID: 26695080.
Goldenberg JZ, Ma SS, Saxton JD, Martzen MR, Vandvik PO, Thorlund K, et al. Probiotics for the prevention of Clostridium difficile–associated diarrhea in adults and children. Cochrane Database Syst Rev 2013;CD006095. doi: 10.1002/14651858.CD006095.pub3. PubMed PMID: 23728658.
Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol 2014;11:506–14. doi: 10.1038/nrgastro.2014.66. Epub 2014 Jun 10. PubMed PMID: 24912386.
Hungin AP, Mulligan C, Pot B, Whorwell P, Agréus L, Fracasso P, et al. Systematic review: probiotics in the management of lower gastrointestinal symptoms in clinical practice — an evidence-based international guide. Aliment Pharmacol Ther 2013;38:864–86. doi: 10.1111/apt.12460. Epub 2013 Aug 27. PubMed PMID: 23981066; PubMed Central PMCID: PMC3925990.
Iqbal S, Quigley EM. Progress in our understanding of the gut microbiome: implications for the clinician. Curr Gastroenterol Rep 2016;18:49. doi: 10.1007/s11894-016-0524-y. PubMed PMID: 27448618.
Li J, Jia H, Cai X, Zhong H, Feng Q, Sunagawa S, et al. An integrated catalog of reference genes in the human gut microbiome. Nat Biotechnol 2014;32:834–41. doi: 10.1038/nbt.2942. Epub 2014 Jul 6. PubMed PMID: 24997786.
Olsen R, Greisen G, Schrøder M, Brok J. Prophylactic probiotics for preterm infants: a systematic review and meta-analysis of observational studies. Neonatology 2016;109:105–12. doi: 10.1159/000441274. Epub 2015 Dec 2. PubMed PMID: 26624488.
Qamar AA. Probiotics in nonalcoholic fatty liver disease, nonalcoholic steatohepatitis, and cirrhosis. J Clin Gastroenterol 2015;49 Suppl 1:S28–32. doi: 10.1097/MCG.0000000000000347. PubMed PMID: 26447961.
Quigley EM. Therapies aimed at the gut microbiota and inflammation: antibiotics, prebiotics, probiotics, synbiotics, anti-inflammatory therapies. Gastroenterol Clin North Am 2011;40:207–22. doi: 10.1016/j.gtc.2010.12.009. PubMed PMID: 21333908.
Roberfroid M, Gibson GR, Hoyles L, McCartney AL, Rastall R, Rowland I, et al. Prebiotic effects: metabolic and health benefits. Br J Nutr 2010;104 Suppl 2:S1–63. doi: 10.1017/S0007114510003363. PubMed PMID: 20920376.
Sanders ME, Merenstein DJ, Ouwehand AC, Reid G, Salminen S, Cabana MD, et al. Probiotic use in at-risk populations. J Am Pharm Assoc 2016;56:680–6.
Sender R, Fuchs S, Milo R. Revised estimates for the number of human and bacteria cells in the body. PLoS Biol 2016;14:e1002533. doi:10.1371/journal.pbio.1002533. eCollection 2016 Aug. PubMed PMID: 27541692; PubMedCentral PMCID: PMC4991899.
Singh S, Stroud AM, Holubar SD, Sandborn WJ, Pardi DS. Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis. Cochrane Database Syst Rev 2015;(11):CD001176. doi: 10.1002/14651858.CD001176.pub3. PubMed PMID: 26593456; PubMed Central PMCID: PMC4917283.
Zhang GQ, Hu HJ, Liu CY, Zhang Q, Shakya S, Li ZY. Probiotics for prevention of atopy and food hypersensitivity in early childhood: a PRISMA-compliant systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore) 2016;95:e2562. doi: 10.1097/MD.0000000000002562. PubMed PMID: 26937896; PubMed Central PMCID: PMC4778993.
5.2 Ссылки в тексте
1. Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014 Aug;11(8):506–14.
2. Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr. 1995 Jun;125(6):1401–12.
3. Sanders ME, Akkermans LM, Haller D, Hammerman C, Heimbach J, Hörmannsperger G, et al. Safety assessment of probiotics for human use. Gut Microbes. 2010;1(3):164–85.
4. Sanders ME, Merenstein DJ, Ouwehand AC, Reid G, Salminen S, Cabana MD, et al. Probiotic use in at-risk populations. J Am Pharm Assoc JAPhA. 2016 Dec;56(6):680–6.
5. Lau CS, Chamberlain RS. Probiotics are effective at preventing Clostridium difficile-associated diarrhea: a systematic review and meta-analysis. Int J Gen Med. 2016 Feb 22;9:27–37.
6. Hamad A, Fragkos KC, Forbes A. A systematic review and meta-analysis of probiotics for the management of radiation induced bowel disease. Clin Nutr Edinb Scotl. 2013 Jun;32(3):353–60.
7. Dang Y, Reinhardt JD, Zhou X, Zhang G. The effect of probiotics supplementation on Helicobacter pylori eradication rates and side effects during eradication therapy: a meta-analysis. PloS One. 2014;9(11):e111030.
8. Grossi E, Buresta R, Abbiati R, Cerutti R, Pro-DIA study group. Clinical trial on the efficacy of a new symbiotic formulation, Flortec, in patients with acute diarrhea: a multicenter, randomized study in primary care. J Clin Gastroenterol. 2010 Sep;44 Suppl 1:S35–41.
9. Allen SJ, Martinez EG, Gregorio GV, Dans LF. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev. 2010;(11):CD003048.
10. Höchter W, Hagenhoff G. (Saccharomyces boulardii in acute adult diarrhea: efficacy and tolerability of treatment.). Munch Med Wochenschr. 1990;(132):188–192.
11. Hempel S, Newberry SJ, Maher AR, Wang Z, Miles JNV, Shanman R, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012 May 9;307(18):1959–69.
12. Szajewska H, Kołodziej M. Systematic review with meta-analysis: Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea. Aliment Pharmacol Ther. 2015 Oct;42(7):793–801.
13. Cimperman L, Bayless G, Best K, Diligente A, Mordarski B, Oster M, et al. A randomized, double-blind, placebo-controlled pilot study of Lactobacillus reuteri ATCC 55730 for the prevention of antibiotic-associated diarrhea in hospitalized adults. J Clin Gastroenterol. 2011 Oct;45(9):785–9.
14. Ouwehand AC, DongLian C, Weijian X, Stewart M, Ni J, Stewart T, et al. Probiotics reduce symptoms of antibiotic use in a hospital setting: a randomized dose response study. Vaccine. 2014 Jan 16;32(4):458–63.
15. Koning CJM, Jonkers DMAE, Stobberingh EE, Mulder L, Rombouts FM, Stockbrügger RW. The effect of a multispecies probiotic on the intestinal microbiota and bowel movements in healthy volunteers taking the antibiotic amoxycillin. Am J Gastroenterol. 2008 Jan;103(1):178–89.
16. Johnson S, Maziade P-J, McFarland LV, Trick W, Donskey C, Currie B, et al. Is primary prevention of Clostridium difficile infection possible with specific probiotics? Int J Infect Dis IJID Off Publ Int Soc Infect Dis. 2012 Nov;16(11):e786-792.
17. Goldenberg JZ, Ma SSY, Saxton JD, Martzen MR, Vandvik PO, Thorlund K, et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children. Cochrane Database Syst Rev. 2013;5:CD006095.
18. Lahtinen SJ, Forssten S, Aakko J, Granlund L, Rautonen N, Salminen S, et al. Probiotic cheese containing Lactobacillus rhamnosus HN001 and Lactobacillus acidophilus NCFM® modifies subpopulations of fecal lactobacilli and Clostridium difficile in the elderly. Age Dordr Neth. 2012 Feb;34(1):133–43.
19. Plummer S, Weaver MA, Harris JC, Dee P, Hunter J. Clostridium difficile pilot study: effects of probiotic supplementation on the incidence of C. difficile diarrhoea. Int Microbiol Off J Span Soc Microbiol. 2004 Mar;7(1):59–62.
20. Lewis S, Burmeister S, Brazier J. Effect of the prebiotic oligofructose on relapse of Clostridium difficile-associated diarrhea: a randomized, controlled study. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc. 2005 May;3(5):442–8.
21. Hauser G, Salkic N, Vukelic K, JajacKnez A, Stimac D. Probiotics for standard triple Helicobacter pylori eradication: a randomized, double-blind, placebo-controlled trial. Medicine (Baltimore). 2015 May;94(17):e685.
22. Ojetti V, Bruno G, Ainora ME, Gigante G, Rizzo G, Roccarina D, et al. Impact of Lactobacillus reuteri Supplementation on Anti-Helicobacter pylori Levofloxacin-Based Second-Line Therapy. Gastroenterol Res Pract. 2012;2012:740381.
23. Manfredi M, Bizzarri B, Sacchero RI, Maccari S, Calabrese L, Fabbian F, et al. Helicobacter pylori infection in clinical practice: probiotics and a combination of probiotics + lactoferrin improve compliance, but not eradication, in sequential therapy. Helicobacter. 2012 Aug;17(4):254–63.
24. Du Y-Q, Su T, Fan J-G, Lu Y-X, Zheng P, Li X-H, et al. Adjuvant probiotics improve the eradication effect of triple therapy for Helicobacter pylori infection. World J Gastroenterol. 2012 Nov 21;18(43):6302–7.
25. Bekar O, Yilmaz Y, Gulten M. Kefir improves the efficacy and tolerability of triple therapy in eradicating Helicobacter pylori. J Med Food. 2011 Apr;14(4):344–7.
26. Tong JL, Ran ZH, Shen J, Zhang CX, Xiao SD. Meta-analysis: the effect of supplementation with probiotics on eradication rates and adverse events during Helicobacter pylori eradication therapy. Aliment Pharmacol Ther. 2007 Jan 15;25(2):155–68.
27. Francavilla R, Polimeno L, Demichina A, Maurogiovanni G, Principi B, Scaccianoce G, et al. Lactobacillus reuteri strain combination in Helicobacter pylori infection: a randomized, double-blind, placebo-controlled study. J Clin Gastroenterol. 2014 Jun;48(5):407–13.
28. Emara MH, Mohamed SY, Abdel-Aziz HR. Lactobacillus reuteri in management of Helicobacter pylori infection in dyspeptic patients: a double-blind placebo-controlled randomized clinical trial. Ther Adv Gastroenterol. 2014 Jan;7(1):4–13.
29. Gluud LL, Vilstrup H, Morgan MY. Non-absorbable disaccharides versus placebo/no intervention and lactulose versus lactitol for the prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev. 2016 May 6;5:CD003044.
30. Lunia MK, Sharma BC, Sharma P, Sachdeva S, Srivastava S. Probiotics prevent hepatic encephalopathy in patients with cirrhosis: a randomized controlled trial. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc. 2014 Jun;12(6):1003–1008.e1.
31. Agrawal A, Sharma BC, Sharma P, Sarin SK. Secondary prophylaxis of hepatic encephalopathy in cirrhosis: an open-label, randomized controlled trial of lactulose, probiotics, and no therapy. Am J Gastroenterol. 2012 Jul;107(7):1043–50.
32. Zhao L-N, Yu T, Lan S-Y, Hou J-T, Zhang Z-Z, Wang S-S, et al. Probiotics can improve the clinical outcomes of hepatic encephalopathy: An update meta-analysis. Clin Res Hepatol Gastroenterol. 2015 Dec;39(6):674–82.
33. Shukla S, Shukla A, Mehboob S, Guha S. Meta-analysis: the effects of gut flora modulation using prebiotics, probiotics and synbiotics on minimal hepatic encephalopathy. Aliment Pharmacol Ther. 2011 Mar;33(6):662–71.
34. Nabavi S, Rafraf M, Somi MH, Homayouni-Rad A, Asghari-Jafarabadi M. Effects of probiotic yogurt consumption on metabolic factors in individuals with nonalcoholic fatty liver disease. J Dairy Sci. 2014 Dec;97(12):7386–93.
35. Eslamparast T, Poustchi H, Zamani F, Sharafkhah M, Malekzadeh R, Hekmatdoost A. Synbiotic supplementation in nonalcoholic fatty liver disease: a randomized, double-blind, placebo-controlled pilot study. Am J Clin Nutr. 2014 Mar;99(3):535–42.
36. Shavakhi A, Minakari M, Firouzian H, Assali R, Hekmatdoost A, Ferns G. Effect of a Probiotic and Metformin on Liver Aminotransferases in Non-alcoholic Steatohepatitis: A Double Blind Randomized Clinical Trial. Int J Prev Med. 2013 May;4(5):531–7.
37. Aller R, De Luis DA, Izaola O, Conde R, Gonzalez Sagrado M, Primo D, et al. Effect of a probiotic on liver aminotransferases in nonalcoholic fatty liver disease patients: a double blind randomized clinical trial. Eur Rev Med Pharmacol Sci. 2011 Sep;15(9):1090–5.
38. Malaguarnera M, Vacante M, Antic T, Giordano M, Chisari G, Acquaviva R, et al. Bifidobacterium longum with fructo-oligosaccharides in patients with non alcoholic steatohepatitis. Dig Dis Sci. 2012 Feb;57(2):545–53.
39. Guglielmetti S, Mora D, Gschwender M, Popp K. Randomised clinical trial: Bifidobacterium bifidum MIMBb75 significantly alleviates irritable bowel syndrome and improves quality of life--a double-blind, placebo-controlled study. Aliment Pharmacol Ther. 2011 May;33(10):1123–32.
40. Ducrotté P, Sawant P, Jayanthi V. Clinical trial: Lactobacillus plantarum 299v (DSM 9843) improves symptoms of irritable bowel syndrome. World J Gastroenterol. 2012 Aug 14;18(30):4012–8.
41. Ford AC, Quigley EMM, Lacy BE, Lembo AJ, Saito YA, Schiller LR, et al. Efficacy of prebiotics, probiotics, and synbiotics in irritable bowel syndrome and chronic idiopathic constipation: systematic review and meta-analysis. Am J Gastroenterol. 2014 Oct;109(10):1547-1561; quiz 1546, 1562.
42. Sisson G, Ayis S, Sherwood RA, Bjarnason I. Randomised clinical trial: A liquid multi-strain probiotic vs. placebo in the irritable bowel syndrome--a 12 week double-blind study. Aliment Pharmacol Ther. 2014 Jul;40(1):51–62.
43. Rogha M, Esfahani MZ, Zargarzadeh AH. The efficacy of a synbiotic containing Bacillus Coagulans in treatment of irritable bowel syndrome: a randomized placebo-controlled trial. Gastroenterol Hepatol Bed Bench. 2014;7(3):156–63.
44. Jafari E, Vahedi H, Merat S, Momtahen S, Riahi A. Therapeutic effects, tolerability and safety of a multi-strain probiotic in Iranian adults with irritable bowel syndrome and bloating. Arch Iran Med. 2014 Jul;17(7):466–70.
45. Choi CH, Jo SY, Park HJ, Chang SK, Byeon J-S, Myung S-J. A randomized, double-blind, placebo-controlled multicenter trial of saccharomyces boulardii in irritable bowel syndrome: effect on quality of life. J Clin Gastroenterol. 2011 Sep;45(8):679–83.
46. Whorwell PJ, Altringer L, Morel J, Bond Y, Charbonneau D, O’Mahony L, et al. Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome. Am J Gastroenterol. 2006 Jul;101(7):1581–90.
47. Moayyedi P, Ford AC, Talley NJ, Cremonini F, Foxx-Orenstein AE, Brandt LJ, et al. The efficacy of probiotics in the treatment of irritable bowel syndrome: a systematic review. Gut. 2010 Mar;59(3):325–32.
48. Guyonnet D, Chassany O, Ducrotte P, Picard C, Mouret M, Mercier C-H, et al. Effect of a fermented milk containing Bifidobacterium animalis DN-173 010 on the health-related quality of life and symptoms in irritable bowel syndrome in adults in primary care: a multicentre, randomized, double-blind, controlled trial. Aliment Pharmacol Ther. 2007 Aug 1;26(3):475–86.
49. Agrawal A, Houghton LA, Morris J, Reilly B, Guyonnet D, Goupil Feuillerat N, et al. Clinical trial: the effects of a fermented milk product containing Bifidobacterium lactis DN-173 010 on abdominal distension and gastrointestinal transit in irritable bowel syndrome with constipation. Aliment Pharmacol Ther. 2009 Jan;29(1):104–14.
50. Sinn DH, Song JH, Kim HJ, Lee JH, Son HJ, Chang DK, et al. Therapeutic effect of Lactobacillus acidophilus-SDC 2012, 2013 in patients with irritable bowel syndrome. Dig Dis Sci. 2008 Oct;53(10):2714–8.
51. Kajander K, Myllyluoma E, Rajilić-Stojanović M, Kyrönpalo S, Rasmussen M, Järvenpää S, et al. Clinical trial: multispecies probiotic supplementation alleviates the symptoms of irritable bowel syndrome and stabilizes intestinal microbiota. Aliment Pharmacol Ther. 2008 Jan 1;27(1):48–57.
52. Paineau D, Payen F, Panserieu S, Coulombier G, Sobaszek A, Lartigau I, et al. The effects of regular consumption of short-chain fructo-oligosaccharides on digestive comfort of subjects with minor functional bowel disorders. Br J Nutr. 2008 Feb;99(2):311–8.
53. Silk DBA, Davis A, Vulevic J, Tzortzis G, Gibson GR. Clinical trial: the effects of a trans-galactooligosaccharide prebiotic on faecal microbiota and symptoms in irritable bowel syndrome. Aliment Pharmacol Ther. 2009 Mar 1;29(5):508–18.
54. Dolin BJ. Effects of a proprietary Bacillus coagulans preparation on symptoms of diarrhea-predominant irritable bowel syndrome. Methods Find Exp Clin Pharmacol. 2009 Dec;31(10):655–9.
55. Lorenzo-Zúñiga V, Llop E, Suárez C, Alvarez B, Abreu L, Espadaler J, et al. I.31, a new combination of probiotics, improves irritable bowel syndrome-related quality of life. World J Gastroenterol. 2014 Jul 14;20(26):8709–16.
56. Yeun Y, Lee J. Effect of a double-coated probiotic formulation on functional constipation in the elderly: a randomized, double blind, controlled study. Arch Pharm Res. 2015 Jul;38(7):1345–50.
57. Ojetti V, Ianiro G, Tortora A, D’Angelo G, Di Rienzo TA, Bibbò S, et al. The effect of Lactobacillus reuteri supplementation in adults with chronic functional constipation: a randomized, double-blind, placebo-controlled trial. J Gastrointest Liver Dis JGLD. 2014 Dec;23(4):387–91.
58. Schumann C. Medical, nutritional and technological properties of lactulose. An update. Eur J Nutr. 2002 Nov;41 Suppl 1:I17-25.
59. Nyman M. Fermentation and bulking capacity of indigestible carbohydrates: the case of inulin and oligofructose. Br J Nutr. 2002 May;87 Suppl 2:S163-168.
60. Waitzberg DL, Logullo LC, Bittencourt AF, Torrinhas RS, Shiroma GM, Paulino NP, et al. Effect of synbiotic in constipated adult women - a randomized, double-blind, placebo-controlled study of clinical response. Clin Nutr Edinb Scotl. 2013 Feb;32(1):27–33.
61. Tursi A, Brandimarte G, Elisei W, Picchio M, Forti G, Pianese G, et al. Randomised clinical trial: mesalazine and/or probiotics in maintaining remission of symptomatic uncomplicated diverticular disease--a double-blind, randomised, placebo-controlled study. Aliment Pharmacol Ther. 2013 Oct;38(7):741–51.
62. Lahner E, Esposito G, Zullo A, Hassan C, Cannaviello C, Paolo MCD, et al. High-fibre diet and Lactobacillus paracasei B21060 in symptomatic uncomplicated diverticular disease. World J Gastroenterol. 2012 Nov 7;18(41):5918–24.
63. Arumugam S, Lau CSM, Chamberlain RS. Probiotics and Synbiotics Decrease Postoperative Sepsis in Elective Gastrointestinal Surgical Patients: a Meta-Analysis. J Gastrointest Surg Off J Soc Surg Aliment Tract. 2016 Jun;20(6):1123–31.
64. Endo H, Higurashi T, Hosono K, Sakai E, Sekino Y, Iida H, et al. Efficacy of Lactobacillus casei treatment on small bowel injury in chronic low-dose aspirin users: a pilot randomized controlled study. J Gastroenterol. 2011 Jul;46(7):894–905.
65. Gionchetti P, Rizzello F, Morselli C, Poggioli G, Tambasco R, Calabrese C, et al. High-dose probiotics for the treatment of active pouchitis. Dis Colon Rectum. 2007 Dec;50(12):2075-2082; discussion 2082-2084.
66. Singh S, Stroud AM, Holubar SD, Sandborn WJ, Pardi DS. Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis. Cochrane Database Syst Rev. 2015;11:CD001176.
67. Bibiloni R, Fedorak RN, Tannock GW, Madsen KL, Gionchetti P, Campieri M, et al. VSL#3 probiotic-mixture induces remission in patients with active ulcerative colitis. Am J Gastroenterol. 2005 Jul;100(7):1539–46.
68. Kruis W, Fric P, Pokrotnieks J, Lukás M, Fixa B, Kascák M, et al. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut. 2004 Nov;53(11):1617–23.
69. Rembacken BJ, Snelling AM, Hawkey PM, Chalmers DM, Axon AT. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial. Lancet Lond Engl. 1999 Aug 21;354(9179):635–9.
70. EFSA Panel on Dietetic Products N and A (NDA). Scientific Opinion on the substantiation of health claims related to live yoghurt cultures and improved lactose digestion (ID 1143, 2976) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA J. 2010 Oct 1;8(10):n/a-n/a.
71. Sakai T, Makino H, Ishikawa E, Oishi K, Kushiro A. Fermented milk containing Lactobacillus casei strain Shirota reduces incidence of hard or lumpy stools in healthy population. Int J Food Sci Nutr. 2011 Jun;62(4):423–30.
72. Szajewska H, Guarino A, Hojsak I, Indrio F, Kolacek S, Shamir R, et al. Use of probiotics for management of acute gastroenteritis: a position paper by the ESPGHAN Working Group for Probiotics and Prebiotics. J Pediatr Gastroenterol Nutr. 2014 Apr;58(4):531–9.
73. Szajewska H, Skórka A, Ruszczyński M, Gieruszczak-Białek D. Meta-analysis: Lactobacillus GG for treating acute gastroenteritis in children--updated analysis of randomised controlled trials. Aliment Pharmacol Ther. 2013 Sep;38(5):467–76.
74. Szajewska H, Skórka A. Saccharomyces boulardii for treating acute gastroenteritis in children: updated meta-analysis of randomized controlled trials. Aliment Pharmacol Ther. 2009 Nov 1;30(9):960–1.
75. Urbańska M, Gieruszczak-Białek D, Szajewska H. Systematic review with meta-analysis: Lactobacillus reuteri DSM 17938 for diarrhoeal diseases in children. Aliment Pharmacol Ther. 2016 May;43(10):1025–34.
76. Szajewska H, Urbańska M, Chmielewska A, Weizman Z, Shamir R. Meta-analysis: Lactobacillus reuteri strain DSM 17938 (and the original strain ATCC 55730) for treating acute gastroenteritis in children. Benef Microbes. 2014 Sep;5(3):285–93.
77. Rafeey M, Ostadrahimi A, Boniadi M, Ghorashi Z, Alizadeh M, Hadafey V. Lactobacillus acidophilus Yogurt and Supplement in Children with Acute Diarrhea: A Clinical Trial. Res J Med Sci. 2008;2(1):13–8.
78. Klanifar H, Farid R, Ahanchian H, Jabbari F, Moghiman T, Sistanian A. Probiotics in the Treatment of Acute Diarrhea in Young Children | Kianifar | Iranian Journal of Medical Sciences. Iran J Med Sci. 2009;34(3):204–207.
79. Lee MC, Lin LH, Hung KL, Wu HY. Oral bacterial therapy promotes recovery from acute diarrhea in children. Acta Paediatr Taiwanica Taiwan Er Ke Yi Xue Hui Za Zhi. 2001 Oct;42(5):301–5.
80. Szymański H, Pejcz J, Jawień M, Chmielarczyk A, Strus M, Heczko PB. Treatment of acute infectious diarrhoea in infants and children with a mixture of three Lactobacillus rhamnosus strains--a randomized, double-blind, placebo-controlled trial. Aliment Pharmacol Ther. 2006 Jan 15;23(2):247–53.
81. Tlaskal P, Schramlova J, Kokesova A, Adamus J, Bubakova D, Kocnarova N. Probiotics in the treatment of diarrheal disease of children. Nutr Aliments Fonct Aliments Santé. 2005;(3):25–8.
82. Canani RB, Cirillo P, Terrin G, Cesarano L, Spagnuolo MI, De Vincenzo A, et al. Probiotics for treatment of acute diarrhoea in children: randomised clinical trial of five different preparations. BMJ. 2007 Aug 18;335(7615):340.
83. Huang Y-F, Liu P-Y, Chen Y-Y, Nong B-R, Huang I-F, Hsieh K-S, et al. Three-combination probiotics therapy in children with salmonella and rotavirus gastroenteritis. J Clin Gastroenterol. 2014 Jan;48(1):37–42.
84. Dubey AP, Rajeshwari K, Chakravarty A, Famularo G. Use of VSL[sharp]3 in the treatment of rotavirus diarrhea in children: preliminary results. J Clin Gastroenterol. 2008 Sep;42 Suppl 3 Pt 1:S126-129.
85. Grandy G, Medina M, Soria R, Terán CG, Araya M. Probiotics in the treatment of acute rotavirus diarrhoea. A randomized, double-blind, controlled trial using two different probiotic preparations in Bolivian children. BMC Infect Dis. 2010 Aug 25;10:253.
86. Szajewska H, Kołodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea in children and adults. Aliment Pharmacol Ther. 2015 Nov;42(10):1149–57.
87. Szajewska H, Canani RB, Guarino A, Hojsak I, Indrio F, Kolacek S, et al. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Children. J Pediatr Gastroenterol Nutr. 2016 Mar;62(3):495–506.
88. Saavedra JM, Bauman NA, Oung I, Perman JA, Yolken RH. Feeding of Bifidobacterium bifidum and Streptococcus thermophilus to infants in hospital for prevention of diarrhoea and shedding of rotavirus. Lancet Lond Engl. 1994 Oct 15;344(8929):1046–9.
89. Liu S, Hu P, Du X, Zhou T, Pei X. Lactobacillus rhamnosus GG supplementation for preventing respiratory infections in children: a meta-analysis of randomized, placebo-controlled trials. Indian Pediatr. 2013 Apr;50(4):377–81.
90. Hatakka K, Savilahti E, Pönkä A, Meurman JH, Poussa T, Näse L, et al. Effect of long term consumption of probiotic milk on infections in children attending day care centres: double blind, randomised trial. BMJ. 2001 Jun 2;322(7298):1327.
91. Hojsak I, Snovak N, Abdović S, Szajewska H, Misak Z, Kolacek S. Lactobacillus GG in the prevention of gastrointestinal and respiratory tract infections in children who attend day care centers: a randomized, double-blind, placebo-controlled trial. Clin Nutr Edinb Scotl. 2010 Jun;29(3):312–6.
92. Agustina R, Kok FJ, van de Rest O, Fahmida U, Firmansyah A, Lukito W, et al. Randomized trial of probiotics and calcium on diarrhea and respiratory tract infections in Indonesian children. Pediatrics. 2012 May;129(5):e1155-1164.
93. Gutierrez-Castrellon P, Lopez-Velazquez G, Diaz-Garcia L, Jimenez-Gutierrez C, Mancilla-Ramirez J, Estevez-Jimenez J, et al. Diarrhea in Preschool Children and Lactobacillus reuteri: A Randomized Controlled Trial. Pediatrics. 2014 Mar 1;peds.2013-0652.
94. Merenstein D, Murphy M, Fokar A, Hernandez RK, Park H, Nsouli H, et al. Use of a fermented dairy probiotic drink containing Lactobacillus casei (DN-114 001) to decrease the rate of illness in kids: the DRINK study. A patient-oriented, double-blind, cluster-randomized, placebo-controlled, clinical trial. Eur J Clin Nutr. 2010 Jul;64(7):669–77.
95. Pedone CA, Arnaud CC, Postaire ER, Bouley CF, Reinert P. Multicentric study of the effect of milk fermented by Lactobacillus casei on the incidence of diarrhoea. Int J Clin Pract. 2000 Nov;54(9):568–71.
96. Pedone CA, Bernabeu AO, Postaire ER, Bouley CF, Reinert P. The effect of supplementation with milk fermented by Lactobacillus casei (strain DN-114 001) on acute diarrhoea in children attending day care centres. Int J Clin Pract. 1999 May;53(3):179–84.
97. Sur D, Manna B, Niyogi SK, Ramamurthy T, Palit A, Nomoto K, et al. Role of probiotic in preventing acute diarrhoea in children: a community-based, randomized, double-blind placebo-controlled field trial in an urban slum. Epidemiol Infect. 2011 Jun;139(6):919–26.
98. Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, et al. World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Probiotics. World Allergy Organ J. 2015;8:4.
99. Cuello-Garcia CA, Brożek JL, Fiocchi A, Pawankar R, Yepes-Nuñez JJ, Terracciano L, et al. Probiotics for the prevention of allergy: A systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol. 2015 Oct;136(4):952–61.
100. AlFaleh K, Anabrees J. Probiotics for prevention of necrotizing enterocolitis in preterm infants. Cochrane Database Syst Rev. 2014 Apr 10;(4):CD005496.
101. Athalye-Jape G, Deshpande G, Rao S, Patole S. Benefits of probiotics on enteral nutrition in preterm neonates: a systematic review. Am J Clin Nutr. 2014 Dec;100(6):1508–19.
102. Athalye-Jape G, Rao S, Patole S. Lactobacillus reuteri DSM 17938 as a Probiotic for Preterm Neonates: A Strain-Specific Systematic Review. JPEN J Parenter Enteral Nutr. 2016 Aug;40(6):783–94.
103. Szajewska H, Horvath A, Kołodziej M. Systematic review with meta-analysis: Saccharomyces boulardii supplementation and eradication of Helicobacter pylori infection. Aliment Pharmacol Ther. 2015 Jun;41(12):1237–45.
104. Sýkora J, Valecková K, Amlerová J, Siala K, Dedek P, Watkins S, et al. Effects of a specially designed fermented milk product containing probiotic Lactobacillus casei DN-114 001 and the eradication of H. pylori in children: a prospective randomized double-blind study. J Clin Gastroenterol. 2005 Sep;39(8):692–8.
105. Szajewska H, Gyrczuk E, Horvath A. Lactobacillus reuteri DSM 17938 for the management of infantile colic in breastfed infants: a randomized, double-blind, placebo-controlled trial. J Pediatr. 2013 Feb;162(2):257–62.
106. Savino F, Cordisco L, Tarasco V, Palumeri E, Calabrese R, Oggero R, et al. Lactobacillus reuteri DSM 17938 in infantile colic: a randomized, double-blind, placebo-controlled trial. Pediatrics. 2010 Sep;126(3):e526-533.
107. Chau K, Lau E, Greenberg S, Jacobson S, Yazdani-Brojeni P, Verma N, et al. Probiotics for infantile colic: a randomized, double-blind, placebo-controlled trial investigating Lactobacillus reuteri DSM 17938. J Pediatr. 2015 Jan;166(1):74–8.
108. Mi G-L, Zhao L, Qiao D-D, Kang W-Q, Tang M-Q, Xu J-K. Effectiveness of Lactobacillus reuteri in infantile colic and colicky induced maternal depression: a prospective single blind randomized trial. Antonie Van Leeuwenhoek. 2015 Jun;107(6):1547–53.
109. Sung V, Hiscock H, Tang MLK, Mensah FK, Nation ML, Satzke C, et al. Treating infant colic with the probiotic Lactobacillus reuteri: double blind, placebo controlled randomised trial. BMJ. 2014 Apr 1;348:g2107.
110. Urbańska M, Szajewska H. The efficacy of Lactobacillus reuteri DSM 17938 in infants and children: a review of the current evidence. Eur J Pediatr. 2014 Oct;173(10):1327–37.
111. Indrio F, Di Mauro A, Riezzo G, Civardi E, Intini C, Corvaglia L, et al. Prophylactic use of a probiotic in the prevention of colic, regurgitation, and functional constipation: a randomized clinical trial. JAMA Pediatr. 2014 Mar;168(3):228–33.
112. Horvath A, Dziechciarz P, Szajewska H. Meta-analysis: Lactobacillus rhamnosus GG for abdominal pain-related functional gastrointestinal disorders in childhood. Aliment Pharmacol Ther. 2011 Jun 1;33(12):1302–10.
113. Guandalini S, Magazzù G, Chiaro A, La Balestra V, Di Nardo G, Gopalan S, et al. VSL#3 improves symptoms in children with irritable bowel syndrome: a multicenter, randomized, placebo-controlled, double-blind, crossover study. J Pediatr Gastroenterol Nutr. 2010 Jul;51(1):24–30.
114. Weizman Z, Abu-Abed J, Binsztok M. Lactobacillus reuteri DSM 17938 for the Management of Functional Abdominal Pain in Childhood: A Randomized, Double-Blind, Placebo-Controlled Trial. J Pediatr. 2016 Jul;174:160–164.e1.
115. Romano C, Ferrau’ V, Cavataio F, Iacono G, Spina M, Lionetti E, et al. Lactobacillus reuteri in children with functional abdominal pain (FAP). J Paediatr Child Health. 2014 Oct;50(10):E68-71.
116. Henker J, Müller S, Laass MW, Schreiner A, Schulze J. Probiotic Escherichia coli Nissle 1917 (EcN) for successful remission maintenance of ulcerative colitis in children and adolescents: an open-label pilot study. Z Gastroenterol. 2008 Sep;46(9):874–5.
117. Turner D, Levine A, Escher JC, Griffiths AM, Russell RK, Dignass A, et al. Management of pediatric ulcerative colitis: joint ECCO and ESPGHAN evidence-based consensus guidelines. J Pediatr Gastroenterol Nutr. 2012 Sep;55(3):340–61.
118. Huynh HQ, deBruyn J, Guan L, Diaz H, Li M, Girgis S, et al. Probiotic preparation VSL#3 induces remission in children with mild to moderate acute ulcerative colitis: a pilot study. Inflamm Bowel Dis. 2009 May;15(5):760–8.
119. Miele E, Pascarella F, Giannetti E, Quaglietta L, Baldassano RN, Staiano A. Effect of a probiotic preparation (VSL#3) on induction and maintenance of remission in children with ulcerative colitis. Am J Gastroenterol. 2009 Feb;104(2):437–43.